Gli esordi di AGT103-T, la terapia genica sperimentale studiata e sperimentata da American Gene Technologies, sono stati col botto - nel senso, non del tutto positivo, di un botto di hype: la company ha presentato il suo progetto di cura dell'infezione da HIV sfruttando la tendenza della stampa ad amplificare le notizie in modo che tutto sembri eccezionale, fantastico, risolutivo e definitivo. Senza sfumature di dubbio, senza distinguo. Tutto già qui.
Nel 2019 questo era prematuro, quindi le vicende di AGT103-T abbiamo deciso di seguirle nell'Osservatorio Stampa.
Oggi la prima sperimentazione è avviata, i comunicati stampa hanno tinte più sobrie e toni più contenuti, ed è giunto il momento di aprire in Verso una cura un thread dedicato a questa sperimentazione.
Cominciamo dunque dagli antefatti, le cui date sono visibili a destra in alto delle citazioni, e poi seguirà l'ultimo comunicato stampa.
Dora ha scritto: ↑domenica 10 novembre 2019, 6:06
AGT103-T: l'American Gene Technologies ha pronta una *cura dell'AIDS*? Evitiamo di mettere il carro davanti ai buoi, per favore!
Azienda farmaceutica annuncia: abbiamo la cura per HIV e AIDS - ieri questo titolone su Futuroprossimo.it apriva le danze per altri pregevoli contributi in italiano all'ennesimo caso di hype autopromozionale proveniente dagli Stati Uniti.
Recitava il sommario per ingolosire i lettori, limitandosi a copiare quanto già era dilagato in inglese a partire da un articolo su BioBuzz, che a sua volta faceva da megafono al comunicato stampa di una non-troppo-famosa biotech del Maryland chiamata American Gene Technologies.Il paper di quasi 1000 pagine contiene nel dettaglio la cura per HIV e AIDS, e chiede il via libera dalla FDA. Si attende un annuncio storico dopo 40 anni.
Ma sapete che c'è? Se non si può proprio dire che sia una bufala, è però una amplificazione quanto meno prematura, perché questa società ha soltanto presentato un normale faldone di documentazione (1000 pagine, embè? - a volte sono anche di più) per richiedere alla Food and Drug Administration lo status di Investigational New Drug per la loro terapia genica e così ottenere il permesso di fare la prima sperimentazione clinica.
L'approccio proposto da American Gene Technologies si chiama AGT103-T ed è certamente interessante, perché - proprio come quello di Sangamo - prevede di introdurre delle modificazioni genetiche che rendano i CD4 resistenti all'HIV, ma - a differenza di quello di Sangamo - si propone di modificare solo i CD4 HIV-specifici, che sono quelli che davvero servono per contrastare il virus. La loro idea è che, rendendo questi CD4 resistenti, si dia loro la capacità di distruggere gli altri CD4 infetti e così diminuire e magari anche eliminare il reservoir, permettendo lunghi periodi di sospensione della cART.
Insieme alla Università del Maryland, stanno già facendo uno studio preparatorio, che consiste nel prelevare campioni di sangue da persone con infezione da HIV ben controllata dalla cART per poter determinare i livelli dei loro CD4 che si sono specializzati a reagire al virus e usare poi questi CD4 per validare l'AGT103-T.
Se la FDA concederà lo status di IND a questa terapia genica sperimentale, potranno partire con un trial di fase I, per testare in vivo sicurezza e tollerabilità dell'AGT103-T.
Se i molti anni di sperimentazioni cliniche cui questa terapia dovrà sottoporsi dimostreranno che, oltre che sicura e ben tollerata, è anche efficace; e se alla fine di tutto questo lunghissimo processo si accerterà che questa terapia può essere estesa a tante persone con infezione da HIV, solo allora si sarà autorizzati a parlare di "cura per HIV e AIDS" - perché poi, cura dell'AIDS? Non c'è già la cART a prevenire e curare l'AIDS?
Dora ha scritto: ↑mercoledì 13 novembre 2019, 6:31Da quando, ormai 6 anni fa, abbiamo istituito questo Osservatorio Stampa, la mania dell'hype in campo medico è esplosa: non passa settimana senza che ci siano titoli strillati e articoli sdraiati sui comunicati stampa dei ricercatori, relativamente a cure, terapie, scoperte eccezionali. Poi le storie si sciolgono come neve al sole, ma intanto hanno portato click, visibilità e introiti pubblicitari. Tanto chi le propaganda sa benissimo che la memoria dei lettori è più corta di quella di un moscerino, mentre la loro depressa voglia di novità li fa passare immediatamente ad altro, e nessuno chiama mai questi giornalisti di corte a rendere conto dell'immane quantità di sciocchezze con cui hanno saturato la rete.
Da quel 30 dicembre 2013 in cui abbiamo deciso di raccogliere qui alcune perle di hype (mentre tante altre sono sparse nei thread dedicati alle specifiche ricerche), qualche altra entità che si occupa di raccontare la ricerca su HIV/AIDS ha creato qualcosa di analogo. Ad esempio, Richard Jefferys cura per TAG un utilissimo Cure Research Media Monitor, in cui segnala i casi di hype più clamorosi che emergono negli Stati Uniti.
In Australia, HIV cure, un sito della NAPWHA (National Association of People With HIV Australia) dedicato prevalentemente a raccogliere informazioni sui trial clinici sulla cura di HIV che si svolgono in Australia, ha pubblicato poche ore fa un articolo di Michael Louella e Miranda Smith sulla vicenda dell'AGT103-T di cui ho scritto domenica scorsa, parlando senza mezzi termini di hype-atite.
Poiché, oltre a raccontare la vicenda, offre alcune utili dritte su come non cascare nella propaganda orchestrata da ricercatori e giornalisti su alcuni studi, ho pensato di riportarlo qui in modo da rendere disponibili a tutti i loro suggerimenti.
ANOTHER CASE OF HIV CURE HYPE-ATITIS
Over the last week, another rash of articles claiming an HIV cure has swept across the web. The underlying story, however, is nowhere near a cure for HIV. The story is not even based on a scientific study. Many media outlets appear to be either ill-equipped or too lazy to report responsibly on HIV cure advances. This has a flow-on effect for everyone who reads their material, including individuals and organisations that pass the message on.
In this article, we outline the real story and where the media went wrong. We also outline some easy steps to help you identify bogus cure claims in the future. Protect yourself against HIV cure hype-atitis!
So, what was at the beginning of the hype?
The news really started as a press release from a company, American Gene Technology (AGT). Their press release (dated 18 October, 2019) announced the submission of an Investigational New Drug (IND) application to the United States Federal Drug Administration (FDA). IND applications are needed to allow early stage clinical trials to be done in humans.
The application related to a gene therapy strategy called AGT103-T. The company has not yet tested this strategy in a single human – either with or without HIV. The IND application would enable human testing to be done legally.
A second announcement (dated 24 October, 2019) detailed plans to combine AGT103-T with a therapeutic HIV vaccine in collaboration with another company, GeoVax.
What is AGT103-T?
AGT103-T involves the insertion of new genes to enhance HIV-specific immunity. Because AGT103-T is being developed as a commercial product, exact details are scarce. There are no published studies in the scientific literature. The company claims that CD4 T cells treated with AGT103-T are both resistant to HIV infection and equipped to attack other cells infected with HIV.
How did all this become news?
Press releases on their own don’t usually generate much interest. Backed by solid science, new discoveries or surprising findings, they become more newsworthy.
Local media in Maryland picked up the original press release and made some unfortunate mistakes. Articles and videos published implied that AGT had a proven cure. This is completely wrong – the strategy is so far untested. Other misleading comments included “the cell and gene therapy is unlike any other” (note: it’s not, and we don’t have exact details on what it is anyway), and “the single-dose drug has a simple purpose – to eradicate HIV so that those infected can win”. This second statement is problematic in at least two ways. First, as there have been no clinical trials on AGT103-T, it cannot be stated that it is single-dose. Second, it implies that people living with HIV are ‘losing’ by continuing to live with the virus.
Amplifying the wrong message
Prominent LGBTIQ media then picked up the story and spread it further. Articles published by US and UK LGBTIQ online outlets continued the hyped-up ‘cure’ story. These stories included direct quotes (obviously unchecked) from the earlier local media stories, including some directly from the AGT CEO. Whether this was due to a naïve enthusiasm for local industry in the original stories, honest mistakes from the LGBTIQ media, or a calculated use of ‘HIV cure’ as clickbait, we will never know. What we do know is that the media, and the HIV organisations who amplify their messages, need to do better on HIV cure.
How to read stories on HIV cure
Here are four questions to help you interpret HIV cure claims (and protect yourself from hype-atitis):
1. Where has the media report been published?
A real breakthrough will be reported in a high-end medical journal or an international media outlet. A cure for HIV is never going to be reported first on magicalspecialpotions.com, or in small, regional media outlets. If you find a report on a specialised website or social media, cross check to see if it’s been published elsewhere!
2. Who or what is the source of the media report?
Is the report based upon a single person’s (or company’s) claim to have developed an HIV cure? Has the claim been presented at a conference or in a medical journal? A report based on someone’s personal claim (or a company’s press release) is not the same as a report from a peer-reviewed scientific study.
3. Who does the media report quote?
If a media report quotes only a person directly linked to the study or announcement, or from someone without expertise in HIV cure research be cautious. Good quality media reports will quote from an expert not directly involved in the research.
4. What is the evidence?
Is the report based on a theory? An actual study? Was the study in an early (lab) or late (clinical) phase? Findings from a small lab study (sometimes not even with people) is very different from a large-scale clinical trial with real people. Moving a study from the lab to the clinic can take decades of work.
Beware of…
Claims of a ‘set timeframe’ (within five years or ten years): many studies take one step forward then two steps back, that is often the nature of research.
Claims of certainty: if something has not been tried before, first it needs to be tested. That takes time.
Claims of an HIV cure: to date, there is only one proven instance of HIV cure and a few dozen reports of remission – there is a big difference.
Claims of ‘balanced reporting’: presenting different opinions in a media report as a ‘balanced’ assessment. For each opinion ask yourself what is the evidence for what each party is claiming?
Claims that are too good to be true: they probably are.
Dora ha scritto: ↑mercoledì 12 agosto 2020, 5:42La primavera scorsa, David Pauza e colleghi della American Gene Technologies hanno pubblicato in open access su Molecular Therapies i dettagli del processo di produzione e dei risultati preclinici dell'AGT103-T:
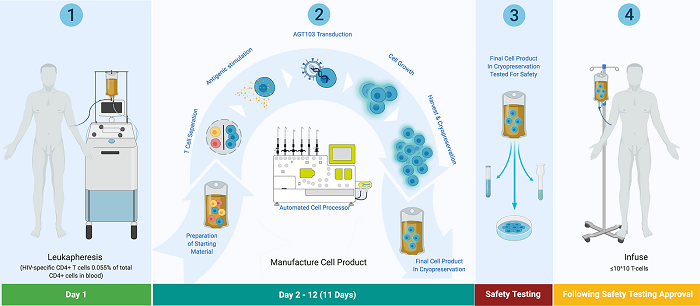
Preclinical Development and Clinical-Scale Manufacturing of HIV Gag-Specific, Lentivirus Modified CD4 T Cells for HIV Functional Cure
Ieri hanno comunicato di aver ricevuto dall'FDA il permesso di fare una sperimentazione clinica di fase I per studiare la sicurezza del loro vettore lentivirale e cominciare a indagare alcuni marker surrogati di efficacia.
Il trial - che non si dice su quante persone sarà, ma certamente poche - si terrà in diversi siti, sarà una collaborazione del Washington Health Institute, della University of Maryland, dell'Institute of Human Virology e della Georgetown University ed è previsto che inizi a settembre.
Secondo il comunicato stampa, si potrebbero avere i primi risultati entro la fine dell'anno.
Inizia così il viaggio nella realtà dell'AGT103-T.
Dora ha scritto: ↑mercoledì 12 agosto 2020, 9:47Se davvero pensano di avere i primi dati sulla sicurezza due-tre mesi dopo l'inizio del trial, vuol dire che i numeri dei partecipanti sono minuscoli (come d'altronde ci si aspetta in una fase I di terapia genica). Ma difficile che ci voglia meno di un anno per avere anche i dati sui marker di efficacia.
Direi di aspettare che iscrivano la sperimentazione in Clinical Trials e poi decidiamo se è il caso di aprire un thread in Verso una Cura.
Certo è però che non vedo tutta questa urgenza.
Speriamo che nel frattempo Pauza e colleghi si esercitino in una comunicazione più sobria e composta ...
Dora ha scritto: ↑domenica 16 agosto 2020, 7:04Mi fa piacere notare che anche a Michael Louella e Richard Jefferys il registro comunicativo di Pauza e colleghi dell'AGT è piaciuto poco:
AGT’s public relations strategy “preys on the emotions of people living with HIV” and “has a deleterious effect on the understanding of the cure field overall,” Seattle advocate Michael Louella told POZ. “They make their outrageous comments, and these are then picked up and believed to be certain truth. Any attempt to promote a more nuanced and better-grounded understanding of gene therapy or the clinical process becomes impossible.”Valga quindi come reminder il logo di questo thread:“Saying ’AGT believes there is a high likelihood that participants in the upcoming trial will be cured’ is beyond outrageous and completely undermines informed consent because it’s an unethical inducement to participate [in trials],” Richard Jefferys of the Treatment Action Group told POZ.
“And it’s not based on a shred of evidence. To my knowledge, there’s no humanized mouse data, no macaque data—it’s all theory,” he continued. "I would hope that they pause to reconsider their PR strategy and broaden their consultation with stakeholders, including community-based advocates.

Dora ha scritto: ↑sabato 17 ottobre 2020, 7:08La primavera scorsa, David Pauza e colleghi della American Gene Technologies hanno pubblicato in open access su Molecular Therapies i dettagli del processo di produzione e dei risultati preclinici dell'AGT103-T:
Preclinical Development and Clinical-Scale Manufacturing of HIV Gag-Specific, Lentivirus Modified CD4 T Cells for HIV Functional Cure
Ieri hanno comunicato di aver ricevuto dall'FDA il permesso di fare una sperimentazione clinica di fase I per studiare la sicurezza del loro vettore lentivirale e cominciare a indagare alcuni marker surrogati di efficacia.
Il trial - che non si dice su quante persone sarà, ma certamente poche - si terrà in diversi siti, sarà una collaborazione del Washington Health Institute, della University of Maryland, dell'Institute of Human Virology e della Georgetown University ed è previsto che inizi a settembre.
Secondo il comunicato stampa, si potrebbero avere i primi risultati entro la fine dell'anno.
Inizia così il viaggio nella realtà dell'AGT103-T.
Dora ha scritto: ↑sabato 17 ottobre 2020, 7:08Una sperimentazione clinica di fase I è stata di recente iscritta in ClinicalTrials.gov:
Study to Evaluate the Safety of a Gene and Cell Therapy Product in Participants With HIV That is Well-Controlled on Antiretroviral Therapy
È una sperimentazione "interventistica", non randomizzata, in aperto, su un numero minuscolo di partecipanti (6 - SEI) divisi in due gruppi: un gruppo riceverà una singola infusione di un piccolo numero di CD4 modificati ("low dose"), l'altro riceverà una singola infusione di un maggior numero di CD4 modificati ("high dose").
L'obiettivo dello studio è quello di stabilire la sicurezza dell'AGT103-T in persone con infezione da HIV ben controllata dalla cART.
Fine dello studio: tra giugno e settembre 2022.
Non sta ancora reclutando pazienti.
Questo è il primo di molti passi per vedere se la realtà corrisponde alle enormi attese generate dalla propaganda dell'American Gene Technologies.
EDIT: aggiornamento del 31.03.2021
Il trial sta reclutando partecipanti. Ultimo aggiornamento del febbraio scorso.