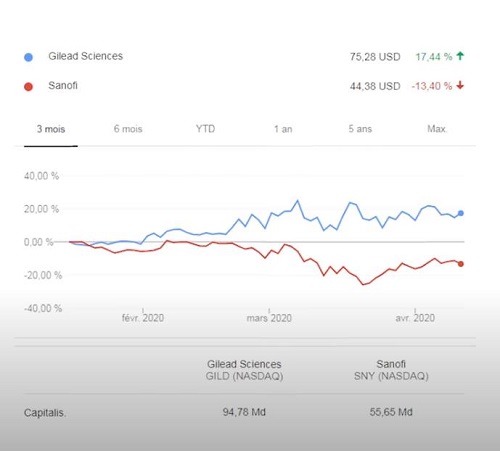
Vorrei fosse chiaro che io non sto tifando contro il remdesivir, sarei felicissima se potesse contribuire efficacemente a curare le persone con COVID-19. Non sto neanche tifando contro Gilead, anche se negli anni ho avuto modo di conoscerne lo stile commerciale e le tante ambiguità.
Non ho neppure nessuna simpatia per Trump, i suoi predicatori fanatici, i ciarlatani come il Dr Oz e il circo di sciroccati che stanno cercando di spacciare la clorochina per una panacea in grado di far sparire per magia il SARS-CoV-2 dalla faccia della terra.
Quello che non sopporto è che per sostenere le proprie strategie farmacologiche preferite si entri in crociata contro le altre - alternative, concorrenti o magari anche complementari - e si distorca la realtà, si coprano le magagne e si inventino i meriti.
Quello che proprio non sopporto è che si usino due pesi e due misure per valutare gli studi scientifici, che il rispetto del metodo scientifico debba valere per alcuni, mentre altri possano fare come gli pare.
Insieme alla onestà intellettuale, anche la verità è una delle vittime illustri di questa epidemia.
Vorrei provare a mantenere l'equilibrio.
P.S. Dopo questo spot pubblicitario per Gilead, adesso mi aspetto che il New England possa pubblicare di tutto.
Eleven reasons the NEJM paper on remdesivir reveals nothing
Grein et al. just published a case series of patients with COVID-19 treated with remdesivir via a compassionate use program. I’ve been expecting this paper with cold dread for some time now. There are several reasons that this publication is a media show, rather than a serious scientific endeavor.
#1. Lack of a control group
As a multi-billion-dollar pharma giant, Gilead has the ability to perform RCTs. Administration of a relatively new drug with unclear side-effects should occur within the context of a controlled trial. Administration of unproven medications under the auspice of compassionate use opens the door to all sorts of unknown toxicities and dangerous practices.
Lack of any control group makes it extremely important that the patients were selected in an unbiased fashion, representing an average group of patients with COVID-19. Unfortunately, this wasn’t the case…
#2. Cherry-picking Patients
Remdesivir was aggressively sought-after by thousands of patients with COVID-19. Of these patients, 61 ended up receiving the drug. Why did these 61 patients receive medication, out of scores of patients applying to receive it?
The manuscript is extremely coy regarding how many patients applied to use remdesivir and how this application process worked. For example, there is no documentation of how many patients applied. There is no data comparing characteristics of patients included in the study versus patients denied medication. Given lack of any control group (#1 above), lack of transparency about this selection process is stunning.
The fact is that Gilead excluded many patients at a higher likelihood of dying (e.g., patients on vasopressors or patients with renal failure). The manuscript doesn’t mention vasopressors, but this was an exclusion factor in the United States.
Through reliable sources, I am aware of one case where a patient was initially denied remdesivir because the patient was too ill (renal failure, vasopressor requirement). Subsequently this patient improved clinically, so Gilead changed their mind and decided that the patient was a candidate for remdesivir! Thus, it seems that the selection process may have been designed to capture patients maximally likely to recover, rather than patients maximally likely to benefit from remdesivir.
#3. Loss of patients due to “no post Day 1 clinical data”
Of 61 patients initially included in the trial, 7 were excluded due to an absence of clinical data after the first trial day. This is disconcerting. What happened to these patients? Did they die from anaphylaxis? Did they get well, sign out against medical advice, and go party? This is unknown – but I’m worried that these patients actually didn’t fare so well.
#4. Lack of defined sample size or stopping rule
Most clinical trials have some pre-determined sample size. Interim analyses may be performed to evaluate for safety. If the study is stopped prior to reaching the goal size, this is frowned upon (as it may introduce an element of bias to the statistical analysis).
This study has no apparent power, or sample size, or anything. It’s undefined as to who decided to stop recruiting for the study or why. If data was being continuously analyzed, it’s possible that the study was terminated at a time when random trends in the data would favor Remdesivir.
#5. Lack of a primary endpoint
Most clinical trials also have a primary endpoint. We could debate whether over-reliance on the primary endpoint is problematic, but nonetheless – having pre-defined primary and secondary endpoints is important to prevent cherry-picking endpoints in a post-hoc fashion.
This study doesn’t seem to have any pre-defined endpoints at all. This allowed the authors to evaluate numerous endpoints and focus on whatever data they wanted to.
#6. Lack of information about the subjects
The baseline data about subjects is very scanty. For example, there is no information about disease biomarkers (e.g. D-dimer, LDH, C-reactive protein, ferritin). There are no markers of global physiologic severity (e.g. SOFA score or APACHE-II scores). Compared to most high-quality retrospective cohort series, this table is notable for its lack of information. In some cases (e.g. absolute lymphocyte count) – we know that this data was collected based on the study protocol – why was this basic data not presented? (My guess is that this data would have shown that the patients weren’t very sick at baseline).
#7. Inclusion of many patients who weren’t very ill
The initial inclusion criterion was anyone saturating 94% or less on room air. This allows the study to include some patients who were minimally ill. Nineteen patients who were included were not intubated, including 2 patients on room air and 10 patients on low-flow nasal cannula. These patients probably would have done well regardless of treatment. Some may not have even warranted hospital admission at all.
#8. Delayed administration of Remdesivir
Remdesivir was administered a median of 12 days after the onset of symptoms (interquartile range of 9-15). This delay may have been partly due to patient application for the drug and selection of patients.
Claiming benefit from a drug administered 12 days after disease onset is dubious for two reasons:
#9. Outcomes weren’t that awesome
- - The natural course of COVID is generally to deteriorate before day #12. So if you select for a group of patients who are still doing OK on day #12, the patients are likely to continue doing fine.
- By 12 days after symptom onset, viremia is generally beginning to decrease (due to immune activation). In fact, most of the clinical illness seen after 12 days may relate more to pathological hyperinflammation, not to direct viral damage. Thus, it doesn’t make sense that an antiviral drug administered this late in the disease course would have much clinical efficacy.
#10. Possible signs of harm are obscured without a control group
23% of patients had serious adverse events (including multi-organ failure, septic shock, acute kidney injury, and hypotension)(table below). Are these true adverse events due to remdesivir? Or are these simply due to COVID infection? Without a control group, it’s anyone’s guess.
The authors concluded that “no new safety signals were detected during short-term remdesivir therapy.” I suppose that it technically correct. Based on the design of this trial, it’s impossible to say anything about the safety of remdesivir at all.
#11. Heavy involvement of pharma
Patient selection was performed by Gilead. Funding was provided by Gilead. Subsequently, the manuscript was largely written by professional writers employed by Gilead.
Over fifty doctors are listed as the co-authors. This author pool obviously has the talent and knowledge to draft an original manuscript. Why couldn’t they write the manuscript on their own, without professional help? Gilead probably didn’t want them to write an original and bias-free manuscript.
Image credit: Photo by Jossuha Théophile on Unsplash
- - This publication is grossly flawed, with many sources of bias. Overall, it reveals no meaningful information about Remdesivir.
- Like any new medication with unclear side-effects, Remdesivir should be subjected to RCTs.
- Gilead is a multi-billion-dollar pharmaceutical company, with ample resources. We are in the midst of a pandemic, with an abundance of COVID patients. There is no excuse for Gilead not to perform a well-powered, double-blind RCT. Hopefully such studies will be forthcoming shortly.
- Until an RCT is performed, further compassionate use of remdesivir probably isn't justified. This may simply represent a distraction when managing these extremely complex patients.