È un testo molto bello, chiaro e dettagliato, che presenta una amplissima bibliografia. Ho quindi ritenuto utile tradurlo per il forum e dedicargli un thread a sé, anche se in diversi altri thread abbiamo discusso i problemi legati all'attivazione immunitaria e all'infiammazione croniche (purtroppo molte delle discussioni sono rimaste nell'archivio del vecchio forum, ma in questo si possono vedere, solo a titolo di esempio: Quali interventi contro l’attivazione immunitaria cronica?; [CROI 2012] Migliorare il GUT: PROBIOTICI, IL-7, HAART; [CROI 2013]Hatano-Deeks_ART, infiammazione, intensificazione; Idrossiclorochina contro l'immunoattivazione? NO GRAZIE!)
La traduzione italiana completa di bibliografia può essere letta più comodamente in un PDF, che può essere scaricato qui, con il titolo: SISTEMA IMMUNITARIO, HIV E INVECCHIAMENTO_TAG.
Il testo in italiano è molto lungo, quindi ho deciso di spezzarlo in due post.
*****************************************
Sistema Immunitario, HIV e Invecchiamento
Introduzione
Una decina di anni fa, era quasi inconcepibile che la questione dell’invecchiare con l’infezione da HIV emergesse come una preoccupazione importante. Ma ora è divenuto chiaro che la terapia antiretrovirale combinata (ART) è in grado di sopprimere la replicazione del virus per molti anni – verosimilmente per tutta la vita – nella maggior parte delle persone che hanno accesso ai farmaci e le infezioni opportunistiche, che un tempo erano la prima causa di malattia, là dove il trattamento è disponibile sono in gran parte scomparse. Morbilità e mortalità per infezione da HIV sono crollate e la sopravvivenza delle persone HIV-positive si approssima sempre più a quella dei loro pari HIV-negativi. Con lo spettro dell’AIDS che è stato finalmente scacciato dall’orizzonte più prossimo, l’attenzione si è rivolta ai problemi di salute che si possono incontrare lungo la strada.
Quelle più incombenti sono le patologie tipicamente associate all’invecchiamento. Fra queste, problemi cardiovascolari, renali ed epatici; perdita ossea e aumentato rischio di fratture; fragilità; deterioramento cognitivo; cancro. Si stanno accumulando prove che il rischio di questi disturbi è elevato nelle persone HIV-positive e, in certi casi, possono verificarsi a un’età mediamente più giovane rispetto a quella in cui si osservano tipicamente in popolazioni HIV-negative simili. Poiché la proporzione di persone con HIV più anziane sta crescendo (vedere figura 1), si pone la pressante necessità di capire come una vasta gamma di fattori possano contribuire a questo fenomeno; e questi fattori includono l’infiammazione, la disregolazione immunitaria, la politerapia, le tossicità dei farmaci nel lungo periodo, le coinfezioni e comorbilità che hanno una prevalenza sproporzionata fra le persone con HIV, quali l’epatite B e C, i disturbi connessi all’uso corrente o pregresso di sostanze, lo stress e la depressione.
È importante sottolineare che l’aumento del rischio di patologie associate all’età riferito nelle persone con HIV (confrontato con le loro controparti HIV-negative) è relativamente piccolo. Inoltre, sussistono delle incongruenze fra gli studi e ci sono discussioni ad oggi non risolte su fino a che punto l’infezione da HIV sia un fattore di rischio indipendente per patologie specifiche.
Pertanto, mentre c’è ragione di allarme e preoccupazione, non c’è ragione di panico ed è verosimile che molte persone HIV-positive non dovranno affrontare un rischio supplementare significativo di problemi legati all’invecchiamento. Come raccomandazione generale, le persone HIV-positive dovrebbero considerare i fattori legati allo stile di vita, che oggi si sa che possono migliorare lo stato di salute quando si raggiunge la vecchiaia; e cioè: fare esercizio quotidiano, seguire una dieta sana, mantenere pressione sanguigna e colesterolo a dei livelli bassi, evitare l’abuso di sostanze e gli eccessivi aumenti di grasso.
L’obiettivo di questo breve report è di sintetizzare la conoscenza scientifica attualmente disponibile riguardo alle connessioni immunologiche fra HIV e invecchiamento e di offrire un’introduzione ad alcune delle questioni non risolte che vengono affrontate – o devono essere affrontate – dalla ricerca.
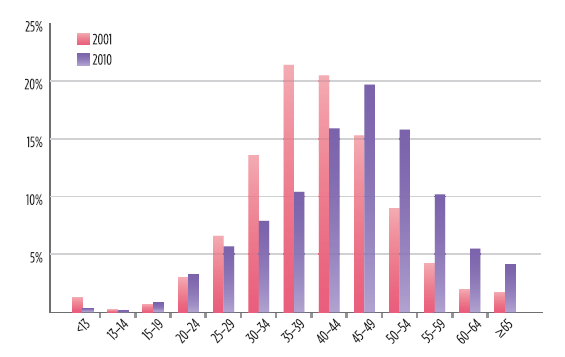
Figura 1. La distribuzione per età delle persone che vivono con l’HIV negli Stati Uniti, basata sulla percentuale di individui in ciascuna categoria d’età nel 2011 confrontata con il 2010 (dati provenienti da aree con segnalazioni confidenziali basate sul nome). L’aumento della popolazione di individui più anziani che vivono con l’HIV è un fenomeno globale. Si stima che nell’Africa sub-sahariana ci siano 3 milioni di persone con HIV che hanno 50 e più anni, più del 13% del totale dei casi di HIV nella regione. Dati recenti dello Swiss HIV Cohort Study mostrano in Europa tendenze simili.

Invecchiamento e patogenesi dell’HIV
Uno dei primi report che associavano l’età con la prognosi dell’infezione da HIV fu pubblicato nel 1987: in una coorte di emofiliaci, l’età più avanzata era associata in modo significativo ad una più rapida progressione verso l’AIDS. Nei due decenni successivi, questa scoperta è stata più volte confermata in tutte le popolazioni.
Si è anche rapidamente dimostrato che l’età aveva un impatto indipendente sul numero dei linfociti T CD4. Sono inoltre stati notati dei parallelismi fra le manifestazioni cliniche dell’AIDS e l’invecchiamento – quali il deterioramento cognitivo, l’atrofia muscolare e la fragilità – e ciò ha spinto alcuni ricercatori ad ipotizzare che la base comune potesse essere immunologica. Tuttavia, a quei tempi, c’erano pochi dati sui cambiamenti immunologici che si verificano durante l’invecchiamento naturale e sui loro rapporti con la salute.
Negli ultimi anni, ha iniziato ad emergere un quadro più chiaro del ruolo del sistema immunitario nell’invecchiamento. A grandi linee, le evidenze suggeriscono che si verifichi un logoramento graduale delle risorse del sistema immunitario, causato in parte dalle molte e diverse infezioni cui un individuo è esposto durante la vita, con le infezioni croniche – quei patogeni che sono controllati, ma non rimossi dal corpo – che svolgono un ruolo particolarmente importante. L’esempio chiave è il citomegalovirus (CMV), che è stato regolarmente associato con disfunzione immunitaria e mortalità (con follow-up da più di due fino a sei anni) in persone molto anziane. Ed è stato ipotizzato anche un possibile contributo dell’infezione da Epstein-Barr virus (EBV).
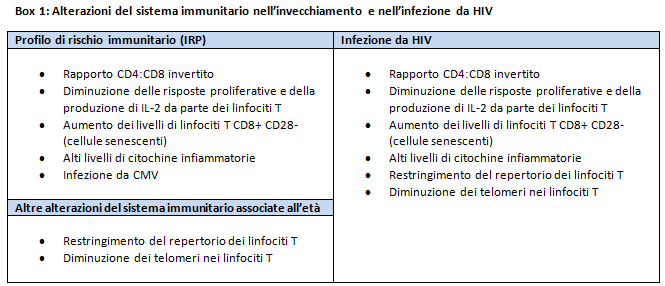
Poiché in età avanzata il sistema immunitario diventa meno competente, pare anche che debba lavorare di più e che ciò porti a uno stato di infiammazione cronica, che è stato descritto come “inflamm-aging”. Un progresso particolarmente importante in questo campo di ricerca è stato l’identificazione di un gruppo di fattori, che erano fortemente predittivi di mortalità più precoce in una coorte svedese di persone anziane (> 85 anni), noti come “profilo di rischio immunologico” o “fenotipo di rischio immunologico” (IRP – vedere box 1). La ricerca sta adesso indagando se l’IRP si applichi anche ad altre popolazioni, comprese quelle di 60 e più anni.

Questi progressi nella ricerca sull’invecchiamento hanno messo in evidenza numerosi sorprendenti parallelismi con la patogenesi dell’infezione da HIV (vedere box 1), ed offrono una nuova lente attraverso la quale guardare precedenti risultati della ricerca. La dimostrazione della pressione cronica esercitata sul sistema immunitario dalla presenza dell’HIV è stata documentata prima ancora che il virus fosse identificato; i primi report di casi di AIDS includevano dati che mostravano livelli elevati di attivazione dei linfociti T, misurati mediante il marker di attivazione CD38 (che allora era noto come T10). Una ricercatrice della University of California, Los Angeles, Janis Giorgi, ha anche dimostrato che l’espressione del CD38 sui CD8 era un forte predittore della velocità di progressione della malattia, una scoperta seminale che è stata ripetutamente confermata in successivi studi indipendenti. È anche stato dimostrato che gli alti livelli di attivazione dei linfociti T in persone con HIV non trattato si accompagnano ad aumenti nelle citochine infiammatorie, come l’IL-6, il TNF-α e l’interferone alfa. Quindi, mentre lo stadio finale dell’infezione da HIV è caratterizzato da deficienza immunitaria, è preceduto da una graduale erosione delle risorse del sistema immunitario causata da attivazione cronica, un processo che può avere un parallelo nel ruolo, da poco descritto, del CMV nell’aggravare il declino immunitario in persone HIV-negative molto anziane.
Dal momento che l’impatto dell’infezione da HIV sul sistema immunitario rispecchia per molti aspetti quello dell’invecchiamento, è possibile che delle manifestazioni che rievocano l’invecchiamento accelerato nelle persone HIV-positive siano totalmente dipendenti dal virus. Tuttavia, ci sono molti altri fattori che possono contribuire. I farmaci antiretrovirali hanno una gamma ben descritta di tossicità che potrebbero plausibilmente svolgere un ruolo, per esempio il danno ai mitocondri, che nelle cellule producono energia (un possibile effetto collaterale degli inibitori nucleosidici della trascrittasi inversa, NRTI), l’aumento dei livelli di colesterolo e trigliceridi (causato da alcuni inibitori della proteasi), lo sviluppo di obesità addominale centrale (che può essere fonte di IL-6 e altre citochine infiammatorie) e la resistenza all’insulina (cui possono contribuire sia gli NRTI, sia gli inibitori della proteasi). Inoltre, esistono fattori di rischio che possono avere una maggiore prevalenza nelle persone HIV-positive, come i disturbi connessi all’uso corrente o pregresso di sostanze, il fumo, lo stress, la depressione e i disturbi del sonno.
La ricerca sulla senescenza immunitaria nell’HIV
Senescenza immunitaria è un termine generale usato per descrivere il profilo immunologico visto nelle persone più anziane. La parola senescente si applica anche alle cellule del sistema immunitario che mostrano segni di disfunzione legata all’età. Anche se la relazione fra immunosenescenza e salute è emersa solo relativamente di recente (e rimane per certi versi controversa), è da molti anni che i ricercatori stanno indagando questo fenomeno nelle persone con HIV.
A metà 1990, Rita Effros, della University of California, Los Angeles, fu la prima a portare le prove che i CD8 stavano raggiungendo uno stato noto come senescenza replicativa nelle persone con HIV. Senescenza replicativa significa che le cellule si sono divise così tante volte che non si dividono più, divenendo così disfunzionali e incapaci di svolgere il loro importante dovere di sorveglianza ed eliminazione delle cellule infettate da patogeni (è questo ruolo che ha fatto guadagnare ai CD8 il nome con cui sono comunemente conosciuti: “linfociti T killer”).
Le prove della senescenza derivavano dalla valutazione della lunghezza dei telomeri nei CD8. I telomeri sono delle sorte di cappucci specializzati che proteggono le estremità di ciascun cromosoma ed evitano la degradazione del DNA quando i cromosomi sono copiati durante la divisione della cellula (comunemente, i telomeri vengono paragonati ai puntali, i piccoli cappucci che proteggono le stringhe delle scarpe per evitare che si sfilaccino). Nel corso di molte divisioni cellulari, i telomeri si accorciano, e l’articolo della Effros ha segnalato che i telomeri nei CD8 prelevati a persone con HIV (in era pre-HAART) avevano lunghezza simile a quella dei CD8 prelevati a persone di 100 e più anni.
Effros ha anche dimostrato che la perdita dell’espressione di una molecola sulla superficie della cellula, il CD28, serve come marker della senescenza replicativa dei CD8. Queste scoperte concordavano con molti studi indipendenti, che avevano documentato l’accumularsi di CD8 privi di CD28 (CD28-negativi) nell’infezione da HIV, sia in adulti, sia in bambini. La presenza di queste cellule è vista con preoccupazione poiché, oltre ad essere meno capaci di proliferare, hanno la tendenza a produrre alti livelli di citochine infiammatorie.
Un altro parallelismo chiave fra infezione da HIV e invecchiamento naturale riguarda la perdita delle cellule immunitarie naive. Le cellule principali del sistema immunitario adattivo – i linfociti T CD4 e CD8 e i linfociti B – si dividono nel corpo ciascuna in due grandi gruppi: le cellule naive, che non hanno ancora incontrato un antigene cui rispondere, e le cellule memoria, che discendono da cellule naive che in qualche momento del passato hanno incontrato un antigene e gli hanno risposto. Quando le persone invecchiano, il numero delle cellule naive diminuisce e le cellule memoria che hanno risposto a molti diversi patogeni incontrati durante la vita si accumulano. La ricerca ha rivelato una molto più rapida deplezione dei CD4, CD8 e linfociti B naive nelle persone con HIV rispetto ai controlli HIV-negativi. Più di recente, è stato sostenuto che il declino nel numero delle cellule naive costituisce un parallelismo ancora più stretto fra HIV e invecchiamento rispetto all’accumularsi di CD8 senescenti.
Esistono diversi meccanismi attraverso i quali l’HIV causa questa accelerazione nella perdita della naïveté immunologica. La replicazione continua del virus attiva in modo persistente le cellule naive, inducendole a differenziarsi in cellule memoria (e quindi sottraendole al gruppo delle cellule naive). L’attivazione immunitaria cronica si associa con una sorta di danno cicatriziale del tessuto dei linfonodi chiamato fibrosi, che si è visto che limita la produzione di fattori necessari al mantenimento del numero delle cellule naive (la fibrosi del tessuto linfatico non è stata ben studiata nelle persone HIV-negative, ma le prove a disposizione fanno pensare che sia più prevalente in chi ha più di 60 anni). Il virus contribuisce anche all’esaurimento delle cellule staminali ematopoietiche (HSC), che danno vita ai linfociti T e B naive in fabbriche di cellule localizzate nel midollo osseo. I livelli di HSC circolanti nelle persone con HIV somigliano a quelli delle persone HIV-negative di più di 75 anni.
Dopo che i linfociti T sono stati prodotti nel midollo, si spostano nel timo (di qui la “T” nel loro nome), un organo collocato dietro lo sterno, che agisce sostanzialmente come un campo di addestramento. La produzione di linfociti T naive da parte del timo diminuisce rapidamente dopo l’infanzia mediante un processo naturale chiamato involuzione timica, e gradualmente rallenta fino a diventare un gocciolio durante la vecchiaia. L’infezione da HIV aggrava questo effetto dell’età, indebolendo la funzionalità del timo fin dai primi stadi dell’infezione. La diminuzione di cellule naive e l’aumento di cellule memoria specifiche per le infezioni croniche (che si verificano sia durante l’invecchiamento, sia nell’infezione da HIV) portano ad avere un repertorio di linfociti T meno diversificato (per diversificato si intende con linfociti T in grado di rispondere a molti antigeni diversi).
Ma ad essere colpite non sono soltanto le cellule del sistema immunitario adattivo. Alcuni studi hanno iniziato a guardare alle componenti del sistema immunitario innato, scoprendo che i monociti negli uomini con HIV di 45 anni o meno sono simili a quelli di persone HIV-negative di più di 65 anni, hanno una funzionalità ridotta e telomeri accorciati.
Due altre caratteristiche che ora sappiamo essere associate all’invecchiamento immunologico sono state documentate nelle persone con HIV, inizialmente, nei primi casi pubblicati, in persone con AIDS, prima di essere approfonditamente documentate in anziani HIV-negativi: l’inversione del rapporto CD4:CD8 (normalmente sul 2:1, ma tipicamente < 1 nell’infezione da HIV non trattata), e la perdita della funzionalità dei CD4, in particolare della capacità dei linfociti T di proliferare in risposta a una stimolazione e di produrre la citochina interleuchina-2 (IL-2).
Il peggioramento dell’invecchiamento immunologico a causa dell’infezione da HIV offre una possibile spiegazione dell’associazione fra età e rischio di progressione della malattia descritta prima. Le persone più anziane partono con un sistema immunitario che è già stato consumato nel corso del tempo, così l’HIV aggrava i deficit associati all’età che sono già presenti.
La senescenza immunitaria nell’era di un efficace trattamento dell’HIV
La soppressione della replicazione dell’HIV mediante la ART porta tipicamente a un declino dell’attivazione immunitaria, una ripresa del numero dei CD4 del sangue periferico e una ricostituzione delle funzioni immunitarie chiave, quali le risposte proliferative ai patogeni opportunisti. Tuttavia, alcuni aspetti della immunosenescenza possono persistere: la ripresa dei CD4 naive è lenta (possono volerci anni) e dipende sia dall'età, sia dal numero dei CD4 al momento di inizio della terapia. I CD8 senescenti (e, per quanto non si accumulino nella stessa misura, anche i CD4) sembrano riluttanti a svanire, anche se i dati disponibili sono ancora molto pochi e servono degli studi più a lungo termine. I livelli di infiammazione arretrano parallelamente all’attivazione immunitaria, ma in genere rimangono al di sopra di quelli riscontrati in persone HIV-negative simili. Mettendo in evidenza l’importanza dell’età, i parametri immunitari dei bambini in ART da tempo si avvicinano molto di più a quelli delle loro controparti HIV-negative, benché il numero dei CD8 attivati e totali rimanga leggermente elevato, così come la proporzione di CD4 memoria.

Attualmente, alcune delle prove più forti che l’immunosenescenza può colpire la salute delle persone con HIV sono indirette: l’età più avanzata e un assortimento di marker di senescenza sono regolarmente associati a scarsa ripresa dei CD4 nonostante la soppressione dell’HIV; in questo caso, si parla di risposta discordante o di non-risposta immunologica. Molti studi hanno dimostrato che le persone in questa situazione presentano un rischio di malattia più elevato rispetto a individui che hanno aumenti dei CD4 più consistenti. Queste scoperte equivalgono alla valutazione dell’aspettativa di vita basata sulle popolazioni e confrontando le persone con HIV in terapia e le loro controparti HIV-negative: un numero di CD4 del sangue periferico > 500/mm3 si associa a un’aspettativa di vita simile, mentre un numero di CD4 < 500/mm3 si correla con un aumentato rischio di morte. Per esempio, una analisi di 3.280 partecipanti HIV-positivi a due grandi trial clinici, tutti in terapia e con viremie soppresse, ha trovato che ci sono stati 28 decessi fra le persone con CD4 compresi fra 350 e 499/mm3, mentre 16 decessi sarebbero stati attesi in una popolazione HIV-negativa comparabile. Nel più ampio gruppo di partecipanti con CD4 superiori a 500/mm3, il numero delle morti (34) ha collimato esattamente con la mortalità attesa dei confronti HIV-negativi.
In linea con questi dati, uno studio recente esteso per un periodo molto lungo sugli aumenti dei CD4 in persone in ART seguite per 12 anni ha suggerito che la ripresa più lenta nelle persone con più di 50 anni sia una ragione sufficiente per incorporare l’attenzione all’età nelle linee guida per il trattamento dell’HIV. Nel marzo 2012, le Guidelines for the Use of Antiretroviral Agents in HIV-1 Infected Adults and Adolescents sono state aggiornate in modo da includere una nuova sezione sulla cura della persone più anziane con HIV, in cui si raccomanda esplicitamente l’inizio della ART in persone di 50 e più anni senza riguardo per il numero dei CD4, “perché il rischio di complicanze non-AIDS correlate può aumentare e la risposta immunologica alla ART può essere ridotta nei pazienti con infezione da HIV più anziani”. Le linee guida, tuttavia, notano che questa è una raccomandazione limitata, basata sull’opinione di esperti tenendo conto della letteratura corrente su invecchiamento e infezione da HIV. Un trial randomizzato e controllato denominato START (Strategic Timing of Antiretroviral Treatment), attualmente in corso, sta valutando l’inizio immediato della ART rispetto a un inizio differito in un’ampia popolazione che spazia in età diverse; i risultati di questo trial dovrebbero fornire prove più chiare sui rischi e i benefici di un inizio immediato della ART nelle persone più anziane con HIV.
Circa le associazioni più dirette fra immunosenescenza e salute nelle persone con HIV, i dati stanno iniziando a comparire solo adesso. Il gruppo di ricerca di Rita Effros ha segnalato che proporzioni più alte di CD8 CD28-negativi erano associate a una più rapida progressione della malattia in uomini arruolati nel Multicenter AIDS Cohort Study (MACS), ma si trattava di un’analisi retrospettiva, che riguardava campioni conservati, mentre servono degli studi prospettici. Uno studio che coinvolgeva 115 donne di 40 e più anni nel Women’s Interagency HIV Study (WIHS) ha trovato una associazione significativa fra la proporzione di CD8 sia attivati, sia senescenti e la presenza di lesioni dell’arteria carotidea, un segnale di disturbo cardiovascolare. Di nuovo, tuttavia, si è trattato di un’indagine retrospettiva su campioni raccolti in un singolo momento – riferito a un’analisi trasversale – ed è necessaria una ricerca prospettica per avere una comprensione più chiara delle associazioni osservate. Ciò nondimeno, gli autori dello studio affermano “prese tutte insieme, queste associazioni sono coerenti con un modello in cui l’infezione da HIV comporta attivazione immunitaria, invecchiamento immunologico accelerato e insorgenza prematura di CVD [disturbo cardiovascolare]”. Inoltre, essi segnalano che nelle persone HIV-negative si è dimostrato che il CMV contribuisce al disturbo cardiovascolare seguendo meccanismi simili.
Un altro studio, questa volta su uomini, ha trovato che diversi parametri di immunosenescenza – compresi più bassi livelli di CD4 e CD8 naive e più alte proporzioni di linfociti T CD28-negativi – sono legati allo sviluppo del sarcoma di Kaposi (KS), nonostante la soppressione dell’HIV grazie alla terapia antiretrovirale. Il KS in questi casi assomiglia alla forma “classica”, in genere benigna, descritta in anziani HIV-negativi, di contro alla forma aggressiva che si è vista nell’AIDS. Mentre serve più ricerca, questi risultati suggeriscono che l’invecchiamento del sistema immunitario possa essere un fattore di rischio per il KS classico, condiviso da giovani con HIV e anziani HIV-negativi.