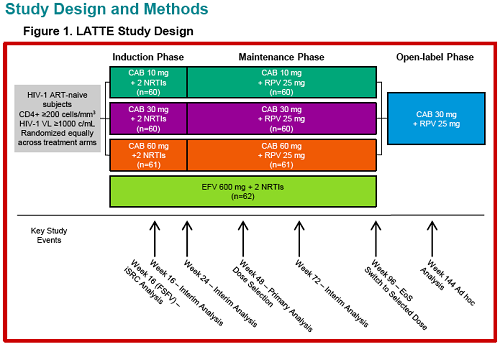
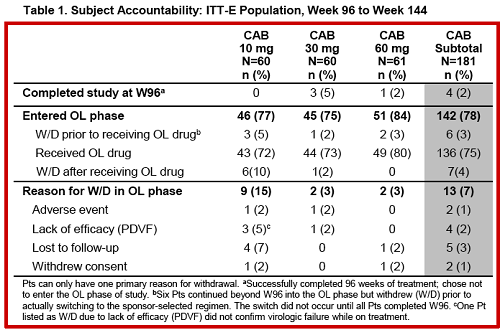
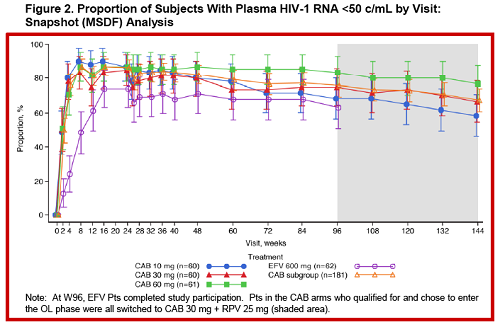
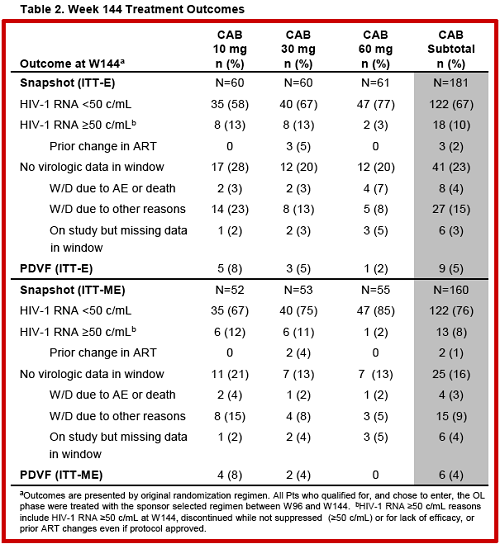
Scusa se rispondo solo adesso, mi piacerebbe essere la Fata Turchina, ma purtroppo non riesco a star dietro a tutto.Triumeq85 ha scritto:Dora leggendo i comunicati spampa GSK e ViiVh pare che la terapia sia disponibile solo a partire dal 2019, ma non è un po' troppo in là con il tempo per un farmaco che si trova gia alla fase IIB dello sviluppo? (con fase III in corso già un po').
Se non mi sbaglio non c'è soluzione di continuità fra la fase IIb e la fase III giusto?
Ho seguito male la discussione fra te e Blast, ma quello che si scopre se si cerca in ClinicalTrials.gov è che il trial di cui stai parlando tu effettivamente è definito di fase IIb/III (forse se avessi riportato il link avresti reso più facile a Blast risponderti - non è una tirata d'orecchi, eh? Solo un suggerimento per il futuro).
È uno studio di confronto fra cabotegravir e Truvada in compresse oppure cabotegravir in versione iniettabile a lunga durata. È uno studio piuttosto lungo, iniziato a marzo 2016 e che si prevede terminerà nel 2020. Ma quello che più conta è che è uno studio per la PrEP, non ha nulla a che vedere con il processo di sperimentazioni che devono portare all'approvazione del cabotegravir. Potrà dunque continuare oltre il momento in cui la FDA avrà approvato il farmaco e può avere una classificazione di fase ambigua fra 2 e 3.