Seguirà un breve aggiornamento da ICAAC 2014.
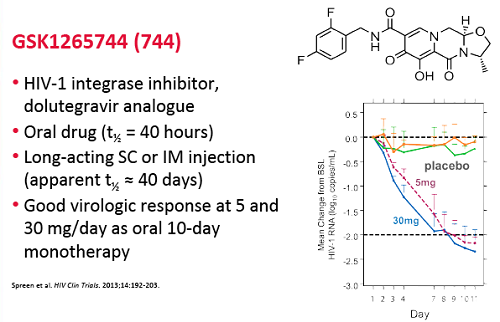
Dora ha scritto:[divbox]GSK 1265744[/divbox] – Inibitore dell’integrasi di GlaxoSmithKline.
Gerardo Garcia-Lerma, Division of HIV/AIDS Prevention, CDC, ha fatto una presentazione dedicata al 744 sotto forma di iniezioni ad azione prolungata, quindi nel suo uso come PrEP: Monthly GSK744 Long-Acting Injections Protect Macaques Against Repeated Vaginal SHIV Exposures. E di questa non intendo al momento parlare, se non per dire che, in questa ricerca, a 6 macachi femmina è stato iniettato il GSK744 una volta al mese per 4 mesi e poi sono state infettate con SIV per via vaginale 2 volte a settimana, per 22 volte. Nessuna delle scimmie ha sviluppato l’infezione, neppure 20 settimane dopo l’ultima iniezione, mentre tutte quelle di controllo, che avevano ricevuto un placebo, sì.
Si pensa dunque di passare a un trial clinico e di usare il 744 come PrEP per donne.
Invece, l’abstract a firma D. Margolis, C. Brinson, J. Eron, et al. è stato dedicato al 744 nel suo uso insieme alla rilpivirina come terapia orale di mantenimento: #91LB - 744 and Rilpivirine as Two-Drug Oral Maintenance Therapy: LAI116482 (LATTE) Week 48 Results (grazie a J.Levin, che ha reso disponibili le figure del poster mancanti dal libro degli abstract).
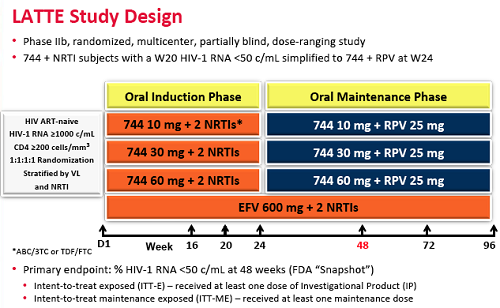
Si tratta della presentazione dello studio LATTE (Long-Acting antiretroviral Treatment Enabling), un trial di fase IIa.
Premessa: lo scorso ottobre, all’ICAAC, GSK aveva portato i dati di una meta-analisi fatta su 8 studi clinici di fase I e Ia, in cui si dimostrava che il 744 era stato ben tollerato e non aveva destato preoccupazioni relative alla sicurezza, sia nella formulazione in pillola, sia sotto forma di iniezioni.
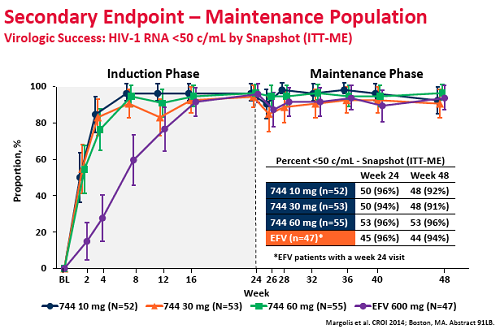
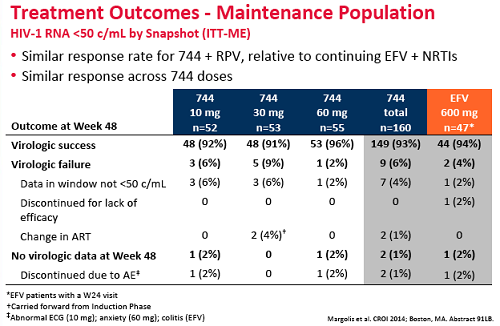
Lo studio portato al CROI ha valutato la combinazione del 744 con un NNRTI, la rilpivirina, confrontandola con combinazioni standard di 2 NRTI + efavirenz e ne ha constatato la non-inferiorità nella soppressione della viremia.
Gli obiettivi dello studio LATTE erano:
- [divbox]• Valutare sicurezza, tollerabilità ed efficacia di tre diversi dosaggi del 744.
• Selezionare la dose ottimale per una successiva valutazione.
• Dimostrare sicurezza ed efficacia di un nuovo regime di mantenimento a 2 farmaci, 744 + rilpivirina.
• Preparare le basi per uno studio di fase IIb, volto a valutare un regime a lento rilascio, basato su iniezioni di 744 + iniezioni di rilpivirina (TMC278).[/divbox]
L’idea è che la rilpivirina e il 744 rimangono così a lungo in circolo, che c’è la possibilità di usarli insieme in una formulazione iniettabile, che possa essere somministrata una volta al mese e liberare i pazienti dall’assunzione quotidiana di pillole. Nelle scimmie le iniezioni di 744 hanno funzionato molto bene. Vedremo la versione iniettabile della rilpivirina, di cui non so niente.
I partecipanti al LATTE sono stati divisi in 4 gruppi e per 6 mesi ciascuno ha preso 2 NRTI – tenofovir/emtricitabina (Truvada) o abacavir/lamivudina (Kivexa) – e come terzo farmaco o l’efavirenz (Sustiva) o uno di tre diversi dosaggi di 744 (10, 30, 60 mg).
Se dopo 6 mesi i partecipanti avevano viremia sotto le 50 copie, allora quelli che stavano prendendo il 744 lasciavano gli NRTI e passavano alla rilpivirina (25 mg).
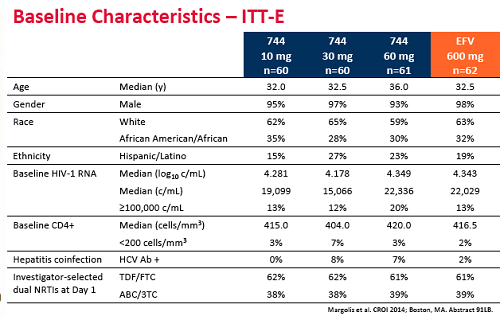
Queste, schematicamente, le caratteristiche di base dei 243 volontari: quasi tutti uomini, età media circa 35 anni, per 2/3 bianchi, il 16% con viremie di partenza superiori alle 100.000 copie, con una media di 410 CD4. Il 69% è partito con il Truvada, il 31% con il Kivexa.
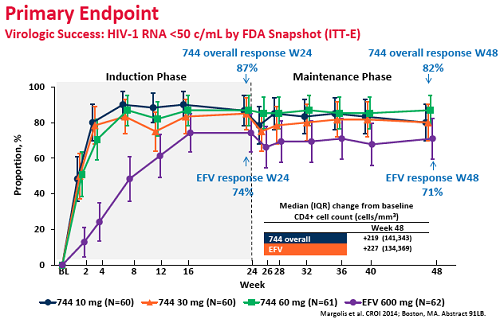
E questi i risultati dello studio a 48 settimane (cioè 24 settimane del regime di mantenimento 744 + rilpivirina):
1. Dopo 24 settimane, l’87% dei partecipanti che assumevano 744 + 2NRTI avevano viremia < 50 copie/mL, con tassi di soppressione praticamente identici per i tre diversi dosaggi, a fronte del 74% di chi assumeva efavirenz.
2. Dopo 48 settimane, l’82% dei partecipanti che avevano iniziato con il 744 manteneva viremia < 50 copie/mL, a fronte dei 71% di chi prendeva efavirenz. Questo 11% di differenza, però, non è statisticamente significativo a causa del basso numero dei partecipanti.
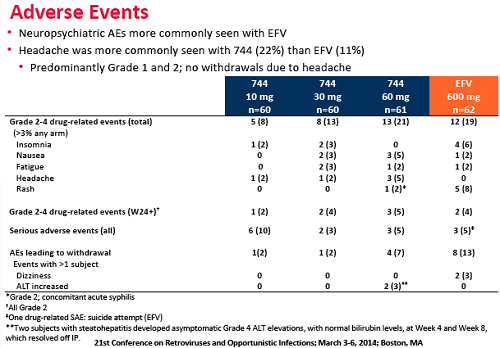
3. Tutta la differenza è dipesa dalla peggiore soppressione virale ottenuta con efavirenz nelle prime 24 settimane a causa del maggior tasso di effetti avversi e tossicità (l’unico effetto collaterale rilevante del 744 è stato il mal di testa, comunque generalmente lieve).
Dora ha scritto:Ho aspettato a risponderti, perché ti avrei solo detto "lo spero anch'io". Ieri, però, è stato pubblicato su Nature Medicine un articolo di Elie Dolgin dedicato proprio ai farmaci ad azione prolungata - Long-acting HIV drugs advanced to overcome adherence challenge - e fra le molte considerazioni interessanti ho trovato anche queste informazioni:ciccio ha scritto:Se da quello che ho capito in altri post una cura è veramente lontana, almeno spero che in un futuro vicino si arrivi a somministrazioni divise in mesi (soluzioni iniettabili) che rendano il tutto più semplice e meno tossico, in modo da poter avere uno stile di vita più regolare e diminuzione di effetti collaterali nel corto e lungo tempo, alla fine dei conti se arriveremo a una specie di convivenza con questa <edit automatico> di virus molti problemi anche di carattere psicologico diminuirebbero. Non dico che diventeremo alla stregua dei diabetici...però almeno ci spero
Dal momento che questi regimi LA-ART costeranno presumibilmente moltissimo, più della ART classica, perché in generale le formulazioni a rilascio prolungato costano in media l'85% in più rispetto ai farmaci equivalenti standard, al Massachusetts General Hospital è stato costruito un modello per valutare la convenienza economica della LA-ART e si è visto che anche a un prezzo così elevato potrebbe essere conveniente per quel 10-15% di persone con documentata scarsa aderenza alla terapia o con una storia di molteplici fallimenti terapeutici. Se poi si riuscisse a farla costare un pochino di meno, secondo questo modello potrebbe anche diventare conveniente come regime di seconda linea. Secondo le stime fatte, circa la metà delle persone con HIV negli Stati Uniti potrebbe optare per un regime di LA-ART.
- 1. GlaxoSmithKline— attraverso ViiV Healthcare, la società dedicata esclusivamente all'HIV che ha creato insieme a Pfizer - sta programmando una sperimentazione in cui le
formulazioni a rilascio prolungato del GSK744 e della rilpivirinaverranno somministrate una o due volte al mese per vedere se un regime totalmente ad azione prolungata (LA-ART: long-acting antiretroviral therapy) riuscirà a dimostrarsi efficace quanto la ART "classica".
2. Una società cinese che si chiama Frontier Biotechnologies ha iniziato a testare su esseri umani l'unico altro farmaco ad azione prolungata che ad oggi si conosca, un inibitore della fusione chiamatoalbuvirtide. In un piccolo studio durato 7 settimane, hanno somministrato un'infusione di albuvirtide una volta a settimana, insieme a 2 compresse al giorno di Kaletra. Secondo quanto ha dichiarato il direttore scientifico della società, hanno osservato "sicurezza eccellente e potente attività anti-HIV".
A febbraio hanno iniziato ad arruolare partecipanti per un trial di fase III: si svolgerà in Cina, durerà 48 settimane e prevede di arruolare 420 volontari.
3. Dei ricercatori del University of Nebraska Medical Center (UNMC) guidati da Howard Gendelman hanno creato una formulazione ad azione prolungata diatazanavir + ritonavir. Iniezioni settimanali di questi farmaci hanno ridotto di 1000 volte le viremie in un modello murino e mantenuto una buona e continua distribuzione dei farmaci nei tessuti e nel sangue in topi e scimmie.
Hanno in programma di passare presto in fase I.