Nuova terapia GSK1265744 in fase II
Re: Nuova terapia GSK1265744 in fase II
Sarebbe bello se incontrassi il nick ''Shagger'' del Poloinformativo, che ha quel bruttissimo ceppo hiv MDR, a lui sembra che la ''Shagger therapy '' .-) cioè fuezon + dolutegravir e viread stia per fortuna andandogli bene. Forza Shaggerone che magari ti faranno provare pure questo...faccio sempre il tifo per lui 
 . Anche lui è di vecchia data come me....abbiamo lo stesso medico....e Dio sa quante volte ci siamo incontrati...ma ho una mezza idea di chi sia....Sai di vecchissimi ormai non siamo rimasti in tanti
. Anche lui è di vecchia data come me....abbiamo lo stesso medico....e Dio sa quante volte ci siamo incontrati...ma ho una mezza idea di chi sia....Sai di vecchissimi ormai non siamo rimasti in tanti  ci riconosciamo ormai dal modo in cui le infermiere stanno zitte
ci riconosciamo ormai dal modo in cui le infermiere stanno zitte 
 ...proverò cesar il 5 ti dico qualcosa di sicuro....c.azzo sono arrivato prima io agli infettivi dei medici che ci lavorano avrò diritto a qualche esclusiva
...proverò cesar il 5 ti dico qualcosa di sicuro....c.azzo sono arrivato prima io agli infettivi dei medici che ci lavorano avrò diritto a qualche esclusiva 

Re: Nuova terapia GSK1265744 in fase II
Riprendo l'elenco di TAG dei farmaci in sperimentazione con dei nuovi dati sul BMS-663068 pubblicati sul Journal of Infectious Diseases, anche se forse dovremmo creare un thread per ogni candidato farmaco (o cambiare titolo a questo, rendendolo più generico, se Cesar è d'accordo).Dora ha scritto:L'elenco dei candidati farmaci in sperimentazione clinica (...)
Da un post scritto oggi da Michael Carter per aidsmap.com.
Attachment inhibitor BMS-663068 does well in early study involving HIV-positive people
Treatment with BMS-663068, an experimental HIV-1 attachment inhibitor, achieves substantial reductions in viral load and has only mild side-effects, results of an eight-day study published in the online edition of the Journal of Infectious Diseases show.
The study involved 48 HIV-positive people, all of whom had a viral load above 5000 copies/ml. These participants were randomised to receive one of five doses of BMS-663068, with or without a 100mg ritonavir booster.
“Short-term dosing of BMS-663068 with or without ritonavir, resulted in substantial declines in plasma HIV-1 RNA levels in both antiretroviral-naïve and antiretroviral-experienced subjects,” comment the authors. All the investigational regimens achieved a drop of viral load of at least 1 log10.
BMS-663068 is a prodrug of the attachment inhibitor BMS-626529. It binds to gp120, a glycoprotein in HIV, preventing the attachment of HIV to CD4 cells. Studies conducted in HIV-negative volunteers showed that BMS-663068 was rapidly converted into the active drug, BMS-626529, with good absorption. The use of a ritonavir booster was shown to enhance exposure to BMS-626529.
Investigators wanted to find out more about the anti-HIV activity, pharmacokinetics and safety of BMS-663068 in HIV-positive people. They therefore designed an eight-day monotherapy study.
Healthy HIV-positive adults were randomised to receive one of five doses of BMS-663068, each of which was taken with food:
- • 600mg BMS-663068 plus 100mg ritonavir every twelve hours.
• 1200mg BMS-663068 plus 100mg ritonavir at bedtime.
• 1200mg BMS-663068 plus 100mg ritonavir every twelve hours.
• 1200mg BMS-663068 plus 100mg ritonavir every morning.
• 1200mg BMS-663068 without a ritonavir booster every twelve hours.
Viral load was monitored before entry to the study, between days 1 and 11, and again on days 15 and 50. CD4 cell count was measured on days 1, 8, 15 and 50. Blood samples were regularly monitored to assess the participants’ susceptibility to the therapy (IC50). Maximum, minimum and steady-state concentrations of the therapy were assessed at regular intervals.
Approximately 70% of participants had never taken HIV therapy before. Median baseline viral load was 25,000 copies/ml, and the median CD4 cell count was 432 cells/mm3.
Overall, there was an increase in viral load during days two and three of therapy. “The etiology for these observations is unknown but is possibly associated with the unique mechanism of action of an attachment inhibitor that binds to the gp120 molecule and does not allow the virus to bind to host cells, thereby resulting in an initial increase of circulating HIV-1 virons detectable in plasma,” suggest the authors.
However, viral load then fell up to day 15 in all treatment groups. It had returned to baseline values by day 50.
The median fall in viral load ranged between 1.21 log10 for the participants taking unboosted BMS-663068 to 1.73 log10 among the participants treated with 1200mg BMS-663068 twice daily with ritonavir.
The authors believe that the poorer virological response in people taking the unboosted drug was because four individuals had reduced susceptibility to BMS-663068. When these participants were excluded from analysis, no significant differences in anti-HIV activity were observed between this and the other treatment arms. Nor did the efficacy of the treatment differ between treatment-naive and treatment-experienced patients.
“Drug susceptibility at baseline has previously been shown to be an important determinant of viral response with this class of drug,” note the researchers.
A viral load below 400 copies/ml was achieved by 18 participants. None of the people with reduced drug susceptibility achieved a viral load below this level.
By day eight, there had been increases in CD4 cell count in all the study arms (between 23 and 130 cells/mm3). However, the investigators were unclear as to the clinical significance of these changes.
Pharmacokinetic analysis showed that use of a ritonavir booster led to only modest increases in drug exposure, which did not translate to improved virological control. “These findings support the further investigation of lower doses of BMS-663068 given without ritonavir in subjects with susceptible virus at baseline,” write the authors.
The treatment appeared to be safe. Two-thirds of patients developed treatment-related side-effects. But these were all mild or moderate. The most frequent were headache, rash and an urgent need to urinate.
“This proof-of-concept study demonstrates the potent antiviral activity of the novel attachment inhibitor prodrug BMS-663068,” conclude the authors. “These data, together with the favourable pharmacokinetic profile and generally good tolerability observed in this study, support the further clinical development of BMS-663068 in combination antiretroviral therapy. A phase IIb study of BMS-663068 in treatment-experienced subjects (NCT01384734) is currently ongoing.”
FONTI:
Re: Nuova terapia GSK1265744 in fase II
molto interessante questo della BMS. 
io sarei, come hai detto tu, per creare un thread dedicato per ciascun farmaco "che merita" l'attenzione, quindi il tuo post lo metterei in uno nuovo, così se ci sono aggiornamenti su uno o sull'altro/i si aggiorna il thread giusto ed è di più facile intuizione leggere direttamente dal titolo... dopo un pò io mi perdo a seguire se il thread ha mille cose dentro...
io sarei, come hai detto tu, per creare un thread dedicato per ciascun farmaco "che merita" l'attenzione, quindi il tuo post lo metterei in uno nuovo, così se ci sono aggiornamenti su uno o sull'altro/i si aggiorna il thread giusto ed è di più facile intuizione leggere direttamente dal titolo... dopo un pò io mi perdo a seguire se il thread ha mille cose dentro...
Re: Nuova terapia GSK1265744 in fase II
Report di Mark Mascolini per Natap sui dati relativi al GSK744 presentati a ICAAC 2012. Seguiranno l'abstract e le slides raccolti da Jules Levin.Dora ha scritto:Sto leggendo il report scritto il mese scorso da Simon Collins per TAG sulla pipeline 2012 dei nuovi antiretrovirali.
Sono segnalate le nuove molecole in sperimentazione clinica, alcune in fasi già abbastanza avanzate da far vedere vicino il momento della commercializzazione.
Nel report sono analizzate soprattutto le sostanze in fase II/III, con particolare attenzione alle co-formulazioni, che sono la moda di quest'anno.
Dell'INI GSK1265744 si sottolinea che lo studio per la formulazione mensile della rilpivirina è stato sospeso, quindi il GSK1265744 è rimasto l'unico farmaco in sperimentazione con questo tipo di somministrazione e la rilpivirina viene tenuta come confronto.
Collins dice che, mentre l'eccitazione per il dolutegravir è sostenuta da tanti dati, anche il GSK1265744 (che ha un'emivita di 30 ore contro una di 15 del dolutegravir) pare interessante, ma di dati ancora ce ne sono pochi.
L'iniezione una volta al mese viene studiata per confrontarne le proprietà farmacologiche con quelle della rilpivirina, data sia in somministrazione orale, sia in iniezione mensile, e con l'obiettivo di usarlo sia all'interno di un regime di ART, sia come PrEP.
Resistance Findings on Experimental S/GSK Long-Acting Integrase Inhibitor
Cell studies showed generally low-level resistance with S/GSK1265744, a long-acting integrase inhibitor that may control HIV with a single shot administered once a month [1]. The findings suggest a high barrier to resistance, limited or low potential for cross-resistance to raltegravir and elvitegravir. However, a site-directed mutant bearing a key double mutation selected by raltegravir selected additional mutations in tests with the new S/GSK compound.
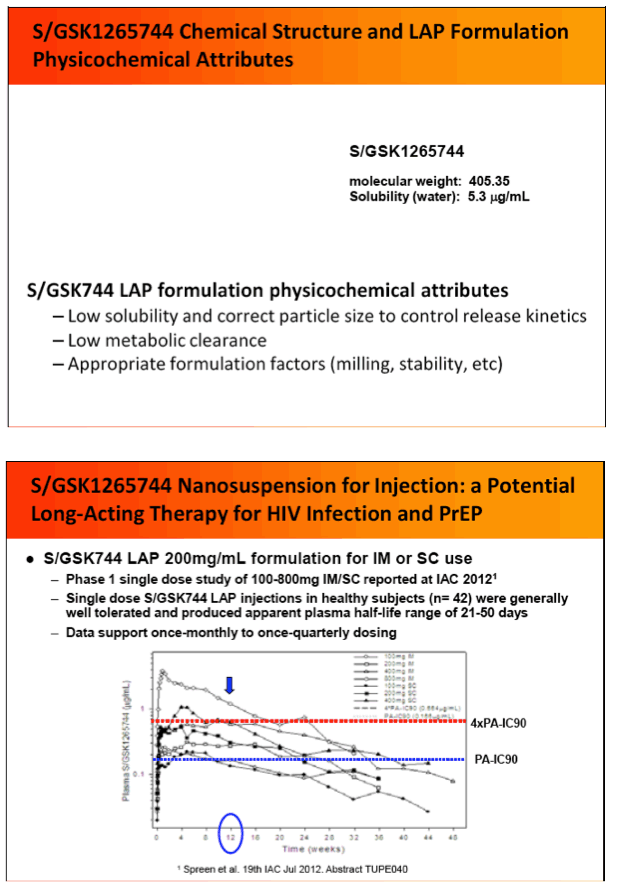
S/GSK1265744, called 744 for short, is being developed in a long-acting parenteral formulation for chronic HIV infection and also possibly for preexposure prophylaxis (PrEP). In an earlier study, 744 showed strong antiviral activity at an oral dose of 30 mg once daily, suppressing viral load by a median 2.6 log10 copies/mL at treatment day 11 [2]. A nanosuspension formulation of 744 had a half-life of 21 to 50 days after a single intramuscular or subcutaneous injection, a result indicating that once-monthly dosing may be possible [3].
The new study assessed resistance to 744 in experiments that passaged an HIV-1 lab strain in MT-2 cells under increasing concentrations of 744. The researchers calculated fold change in resistance to 744 as a ratio of 50% inhibitory concentration (IC50) against wild-type (nonmutant) virus.
The IC50 of 744 in human peripheral blood mononuclear cells was 0.22 nM. IC50s for raltegravir, elvitegravir, and dolutegravir in PMBCs were 2 nM, 2 nM, and 0.51 nM. The 744 compound had a 408-fold potency shift in 100% human serum, compared with shifts of 4.7-fold for raltegravir, 22-fold for elvitegravir, and 75-fold for dolutegravir.
Exposure of HIV-infected MT-2 cells to 744 for up to 112 days did not produce highly resistant mutant virus. Maximum resistance to S/GSK744 in these assays was 8.4-fold.
Ten site-directed molecular clones containing a single raltegravir- or elvitegravir-associated mutation had less than a 2-fold change in susceptibility to 744. The mutations Q148K and K148R, which make HIV resistant to raltegravir, yielded only 5.6-fold and 5.1-fold changes in susceptibility to 744. Fifteen site-directed molecular clones containing 14 double mutations had less than a 12-fold change in susceptibility to 744.
In response to a question after the presentation, Shionogi's T. Yoshinaga said they had tested 744 against virus containing the double mutant with substitutions at positions 140 and 148 (often selected by raltegravir [4]), as in a previous study with dolutegravir. Like dolutegravir, 744 selected additional mutations in virus already harboring those critical changes.
References
- 1. Yoshinaga T, Kobayashi M, Seki T, et al. Antiviral characteristics of S/GSK1265744, an HIV integrase inhibitor (INI) dosed by oral or long-acting parenteral injection. 52nd Interscience Conference on Antimicrobials and Chemotherapy (ICAAC). September 9-12, 2012. San Francisco. Abstract H-550.
2. Min S, et al. Pharmacokinetics (PK) and safety in healthy and HIV-infected subjects and short-term antiviral efficacy of S/GSK1265744, a next generation once daily HIV integrase inhibitor. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy. September 2009. San Francisco. Abstract H-1228. NATAP Report: Pharmacokinetics (PK) and Safety in Healthy and HIV-Infected Subjects and Short-Term Antiviral Efficacy of S/GSK1265744, a Next Generation Once Daily HIV Integrase Inhibitor - (09/17/09)
3. Spreen W, Ford SL, Chen S, et al. Pharmacokinetics, safety and tolerability of the HIV integrase inhibitor S/GSK1265744 long acting parenteral nanosuspension following single dose administration to healthy adults. XIX International AIDS Conference July 22-27, 2012. Washington, DC, Poster TUPE040. NATAP Report: Pharmacokinetics, Safety and Tolerability of the HIV Integrase Inhibitor S/GSK1265744 Long Acting Parenteral Nanosuspension Following Single Dose Administration to Healthy Adults - (07/25/12)
4. Saladini F, Meini G, Bianco C, et al. Prevalence of HIV-1 integrase mutations related to resistance to dolutegravir in raltegravir naïve and pretreated patients. Clin Microbiol Infect. 2012;18:E428-E430.
*********************************************
Antiviral Characteristics Of S/GSK1265744, An HIV Integrase Inhibitor (INI) Dosed By Oral Or Long-acting Parenteral Injection....once monthly or 3 months dosing/PrEP/HAART
ABSTRACT
Background: S/GSK1265744 (S/GSK744) is a potent and selective HIV INI with improved in vitro resistance profile over 1st generation INIs. S/GSK744 has exceptional pharmacokinetic (PK) properties in early human oral delivery trials and robust antiviral activity with a -2.5 log10 copies/mL decrease at day11 during 30mg QD monotherapy. Additional S/GSK744 attributes (low solubility, low clearance) support parenteral dosing at ≤ once monthly. Infrequent dosing may enable improved adherence and efficacy for both HIV therapy and pre-exposure prophylaxis (PrEP). We report here the virological characteristics of 744 including results of in vitro passage and cross-resistance panel studies.
Methods: Antiviral potency of S/GSK744 in cell culture and the effect of human serum proteins were measured by MTT assay. HIV-1 IIIB was passaged in MT-2 cells under increasing S/GSK744 concentrations and the IN gene was sequenced. Fold changes (FC) of mutants during passages and site directed molecular clones (SDMs) were calculated as a ratio of IC50 against WT with a HeLa-CD4 assay.
Results: S/GSK744 IC50's in human peripheral blood mononuclear cells (PBMC) ranged from 0.22 to 0.34 nM. In vitro studies provided a protein adjusted IC50 estimate of 102 nM. Exposure of MT-2 cells infected with HIV-1 IIIB to S/GSK744 for up to 112 days did not produce any highly resistant mutants, with a maximum 8.4 fold resistance. Eight SDM's containing single RAL mutaionts were < 2 FC, except for Q148K/R (5.6/5.1 FC, respectively). S/GSK744 FCs of 14 double mutants among 15 SDMs were < 12.
Conclusions: S/GSK1265744 showed limited cross-resistance to both RAL and EVG, and potential for a high barrier to resistance. Given these in vitro data and demonstrated therapeutic levels with LAP dosing, S/GSK744 may have a favorable profile for both HIV treatment and PrEP. Additional studies are underway to further characterize its potential.

Re: Nuova terapia GSK1265744 in fase II
Volevo ringraziarvi tutti, Dora soprattutto, ma anche tutti gli altri HLA, sky eccetera, non riesco a nominarvi tutti.
Non capisco tutto, anzi quasi una cippalippa, ma almeno riuscite a farmi formare un'idea di quello che sta succedendo.
E' vero che, non negatelo, in parte vi piaccia anche informarvi su queste sperimentazioni, ma so che non é facile, avete dovuto studiare e che magari preferireste trascorrere il vostro tempo che so, a limonare, andare al cinema o quant'altro!! per cui grazie per dare la possibilità a quelli come me che non hanno alcun tempo a disposizione per formarsi una cultura specializzata come la vostra ma che ogni tanto voglio e sentono il bisogno di informarsi.
per cui grazie per dare la possibilità a quelli come me che non hanno alcun tempo a disposizione per formarsi una cultura specializzata come la vostra ma che ogni tanto voglio e sentono il bisogno di informarsi.
Grazie ancora a tutti!
Non capisco tutto, anzi quasi una cippalippa, ma almeno riuscite a farmi formare un'idea di quello che sta succedendo.
E' vero che, non negatelo, in parte vi piaccia anche informarvi su queste sperimentazioni, ma so che non é facile, avete dovuto studiare e che magari preferireste trascorrere il vostro tempo che so, a limonare, andare al cinema o quant'altro!!
Grazie ancora a tutti!
Re: Nuova terapia GSK1265744 in fase II
Antiretrovirali, forse basterà una sola iniezione al mese
uno studio appena presentato al congresso annuale dell’International AIDS Society, conclusosi da poco a Kuala Lumpur, in Malesia, iniezioni mensili di una combinazione di due nuovi antiretrovirali sperimentali – GSK744 di GlaxoSmithKline e TMC278 di Johnson & Johnson – portano a livelli ematici dei due farmaci potenzialmente in grado di tenere a bada il virus HIV. I risultati suggeriscono, inoltre, che le iniezioni potrebbero essere potenzialmente più sicure e più comode del trattamento quotidiano con i farmaci per via orale.
Il trial è stato condotto su 40 volontari sani, sieronegativi, che hanno assunto una formulazione orale di GSK744 una volta al giorno per 2 settimane, poi hanno interrotto il trattamento per una settimana e infine sono stati trattati con una di tre diverse combinazioni delle iniezioni una volta al mese per 4 mesi. Un quarto gruppo è stato trattato con due iniezioni a distanza di 3 mesi l’una dall’altra.
I risultati mostrano che le iniezioni mensili permettono di raggiungere livelli ematici di farmaco superiori alla soglia necessaria per tenere sotto controllo l’HIV per almeno quattro mesi dopo l'ultima iniezione.
Dagli albori della terapia antiretrovirale, quando i pazienti dovevano assumere fino a 30 pastiglie al giorno, ad oggi, che l’infezione si può trattare con combinazioni tutto-in-uno, riunite in un’unica compressa, come efavirenz/emtricitabine/tenofovir (Atripla), se n’è fatta di strada. Tuttavia, resta il problema che la terapia è cronica e a lungo andare può danneggiare il fegato. Per questo, i produttori dei farmaci anti-HIV sono alla continua ricerca di nuove opzioni, ancora più pratiche e sicure. GSK e J&J stanno ora valutando se le iniezioni della loro combinazione siano in grado di tenere sotto controllo la viremia negli individui sieropositivi.
Bill Spreen, il ricercatore di GSK responsabile dello sviluppo di GSK744, ha detto che di ritenere che possa esserci un sottogruppo di pazienti interessato a questa possibilità, potenzialmente più sicura delle terapie orali. E in una survey su 400 pazienti sieropositivi, pubblicata sul numero di aprile della rivista Nanomedicine, l’84% degli intervistati ha detto che proverebbe senza esitazione la terapia iniettabile una volta al mese.
Spreen ha aggiunto che le iniezioni trimestrali potrebbero essere utili ed efficaci per prevenire l'infezione da HIV nei soggetti ad alto rischio. Diversi studi, ormai, dimostrano che la profilassi pre-esposizione (PrEP) con tenofovir o con la combinazione emtricitabina/tenofovir può ridurre il rischio di contagio, ma evidenziano che l’efficacia del trattamento preventivo è limitata pesantemente dalla scarsa aderenza al trattamento. Un’iniezione da fare ogni 3 mesi, anziché una pillola da prendere tutti gironi, potrebbe risolvere o quanto meno ridimensionare questo problema.
GSK744 è sviluppato da ViiV Healthcare, una joint venture tra GSK, Pfizer e la giapponese Shionogi. Il farmaco è simile all’antiretrovirale sperimentale dolutegravir, che, secondo alcuni analisti, potrebbe essere approvato entro agosto e realizzare vendite superiori al miliardo di dollari entro il 2018. TMC278, invece, è una versione iniettabile di rilpivirina orale, approvata nel 2011 da Ema ed Fda.
W. Spreen, et al. First study of repeat dose co-administration of GSK1265744 and TMC278 long-acting parenteral nanosuspensions: pharmacokinetics, safety and tolerability in healthy adults. IAS 2013; abstract WEAB0103.
Articolo divulgativo:
http://www.pharmastar.it/index.html?cat=5&id=11774
Abstract:
http://pag.ias2013.org/abstracts.aspx?aid=796
uno studio appena presentato al congresso annuale dell’International AIDS Society, conclusosi da poco a Kuala Lumpur, in Malesia, iniezioni mensili di una combinazione di due nuovi antiretrovirali sperimentali – GSK744 di GlaxoSmithKline e TMC278 di Johnson & Johnson – portano a livelli ematici dei due farmaci potenzialmente in grado di tenere a bada il virus HIV. I risultati suggeriscono, inoltre, che le iniezioni potrebbero essere potenzialmente più sicure e più comode del trattamento quotidiano con i farmaci per via orale.
Il trial è stato condotto su 40 volontari sani, sieronegativi, che hanno assunto una formulazione orale di GSK744 una volta al giorno per 2 settimane, poi hanno interrotto il trattamento per una settimana e infine sono stati trattati con una di tre diverse combinazioni delle iniezioni una volta al mese per 4 mesi. Un quarto gruppo è stato trattato con due iniezioni a distanza di 3 mesi l’una dall’altra.
I risultati mostrano che le iniezioni mensili permettono di raggiungere livelli ematici di farmaco superiori alla soglia necessaria per tenere sotto controllo l’HIV per almeno quattro mesi dopo l'ultima iniezione.
Dagli albori della terapia antiretrovirale, quando i pazienti dovevano assumere fino a 30 pastiglie al giorno, ad oggi, che l’infezione si può trattare con combinazioni tutto-in-uno, riunite in un’unica compressa, come efavirenz/emtricitabine/tenofovir (Atripla), se n’è fatta di strada. Tuttavia, resta il problema che la terapia è cronica e a lungo andare può danneggiare il fegato. Per questo, i produttori dei farmaci anti-HIV sono alla continua ricerca di nuove opzioni, ancora più pratiche e sicure. GSK e J&J stanno ora valutando se le iniezioni della loro combinazione siano in grado di tenere sotto controllo la viremia negli individui sieropositivi.
Bill Spreen, il ricercatore di GSK responsabile dello sviluppo di GSK744, ha detto che di ritenere che possa esserci un sottogruppo di pazienti interessato a questa possibilità, potenzialmente più sicura delle terapie orali. E in una survey su 400 pazienti sieropositivi, pubblicata sul numero di aprile della rivista Nanomedicine, l’84% degli intervistati ha detto che proverebbe senza esitazione la terapia iniettabile una volta al mese.
Spreen ha aggiunto che le iniezioni trimestrali potrebbero essere utili ed efficaci per prevenire l'infezione da HIV nei soggetti ad alto rischio. Diversi studi, ormai, dimostrano che la profilassi pre-esposizione (PrEP) con tenofovir o con la combinazione emtricitabina/tenofovir può ridurre il rischio di contagio, ma evidenziano che l’efficacia del trattamento preventivo è limitata pesantemente dalla scarsa aderenza al trattamento. Un’iniezione da fare ogni 3 mesi, anziché una pillola da prendere tutti gironi, potrebbe risolvere o quanto meno ridimensionare questo problema.
GSK744 è sviluppato da ViiV Healthcare, una joint venture tra GSK, Pfizer e la giapponese Shionogi. Il farmaco è simile all’antiretrovirale sperimentale dolutegravir, che, secondo alcuni analisti, potrebbe essere approvato entro agosto e realizzare vendite superiori al miliardo di dollari entro il 2018. TMC278, invece, è una versione iniettabile di rilpivirina orale, approvata nel 2011 da Ema ed Fda.
W. Spreen, et al. First study of repeat dose co-administration of GSK1265744 and TMC278 long-acting parenteral nanosuspensions: pharmacokinetics, safety and tolerability in healthy adults. IAS 2013; abstract WEAB0103.
Articolo divulgativo:
http://www.pharmastar.it/index.html?cat=5&id=11774
Abstract:
http://pag.ias2013.org/abstracts.aspx?aid=796
Nuova terapia GSK1265744 in fase II
Mmm... a me la pastiglia non è che pesi, però un'iniezione ogni tre mesi vorrebbe dire che vai a fare gli esami del sangue e, con la stessa cannula che hai già nel braccio, prima riempiono le provette e poi ti iniettano il farmaco: due lavori con un buco solo!
HIVforum ha bisogno anche di te!
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
se vuoi offrire le tue conoscenze tecniche o linguistiche (c'è tanto da tradurre) o sostenere i costi per mantenere e sviluppare HIVforum, contatta con un PM stealthy e uffa2, oppure scrivi a staff@hivforum.info
Re: Nuova terapia GSK1265744 in fase II
Ho letto lo studio nel dettaglio e gli effetti collaterali riscontrati sono in pratica solo a livello locale (dolore nel sito di iniezione), qualcuno ha avuto un leggero mal di testa, nessuno ha riportato effetti gravi di grado 4. Pertanto questo trial ci dice innanzitutto che il GSK1265744 è assolutamente ben tollerato.
In tutti i gruppi, le concentrazioni plasmatiche del farmaco hanno raggiunto i livelli previsti per essere definiti terapeutici entro i tre giorni successivi. I livelli di GSK1265744 e rilpivirina (sì, ce l'hanno messa) hanno raggiunto concentrazioni di inibizione oltre il 90%.
Sui tempi tra una punturina e l'altra aspetterei ulteriori passaggi, ma diciamo che se le cose (e ripeto SE) filassero lisce come è andata fino ad ora, questa potrebbe essere la prima vera alternativa alla HAART. Ora il trial è in fase IIb, pertanto di strada ce n'è ancora e potremmo aspettarci sorprese...ma su questo io sono fiducioso. Rimaniamo attenti sul pezzo
In tutti i gruppi, le concentrazioni plasmatiche del farmaco hanno raggiunto i livelli previsti per essere definiti terapeutici entro i tre giorni successivi. I livelli di GSK1265744 e rilpivirina (sì, ce l'hanno messa) hanno raggiunto concentrazioni di inibizione oltre il 90%.
Sui tempi tra una punturina e l'altra aspetterei ulteriori passaggi, ma diciamo che se le cose (e ripeto SE) filassero lisce come è andata fino ad ora, questa potrebbe essere la prima vera alternativa alla HAART. Ora il trial è in fase IIb, pertanto di strada ce n'è ancora e potremmo aspettarci sorprese...ma su questo io sono fiducioso. Rimaniamo attenti sul pezzo
