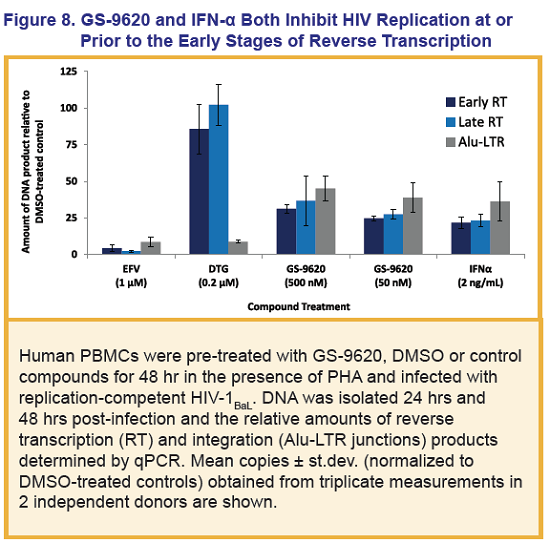
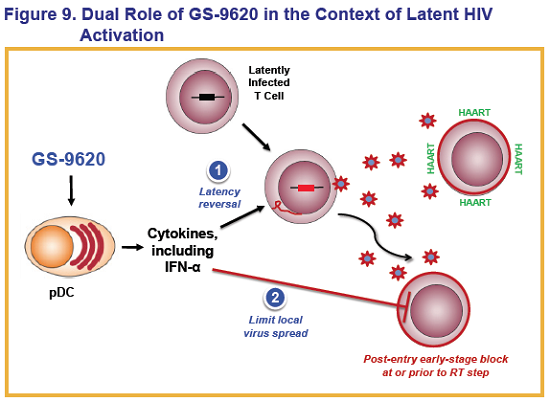
GS-9620 è un agonista selettivo del Toll-Like Receptor 7 sperimentato da Gilead, che si trova già in fase clinica per indurre la soppressione prolungata del virus dell’epatite B in persone con infezione cronica.
Al CROI sono stati presentati due lavori, uno in cui un analogo del GS-9620 è stato somministrato a macachi rhesus con SIV controllato dalla ART; e uno in cui è stata studiata ex vivo l’attivazione dell’HIV mediante GS-9620 in CD4 prelevati da persone con HIV, sempre con viremia soppressa:
- - Treatment With a TLR7 Agonist Induces Transient Viremia in SIV-Infected ART-Suppressed Monkeys
- TLR7 Agonist GS-9620 Activates HIV-1 in PBMCs from HIV-Infected Patients on cART
Partiamo dalla presentazione della ricerca sulle scimmie, che James Whitney, del Beth Israel Deaconess Medical Center, Harvard Medical School di Boston ha fatto ieri durante la sessione dedicata ai New Insights Into HIV Persistence, Latency Reversal, and Viremia Rebound. Seguirà il poster, ricevuto su cortesia di J.Levin e non ancora online nel sito del CROI.
Whitney ha ricordato come, nel campo della cura dell’HIV, la teoria più realistica per arrivare a una cura funzionale proposta fino ad oggi è quella di promuovere per via farmacologica uno stato di remissione in assenza di terapia antiretrovirale e, poiché la ART per questo non è sufficiente, si stanno valutando diverse possibilità, sia per riattivare il virus latente, sia per rinforzare la risposta immune. Questo è noto come “kick – o shock – and kill” e un punto chiave di questa strategia è l’inversione della latenza, ovvero la riattivazione del virus.
In fase di sviluppo clinico abbiamo già sia degli inibitori dell’istone-deacetilasi, sia degli agonisti della protein-chinasi C (PKC), che hanno il compito di forzare la replicazione del virus in cellule quiescenti, che di per sé risultano invisibili. Poi, una volta ottenuta la riattivazione del virus, la cellula dovrebbe essere riconoscibile da parte del sistema immunitario. A ciò si deve aggiungere una fase di immunomodulazione, che potenzi l’efficienza del sistema immunitario nella distruzione delle cellule infette.
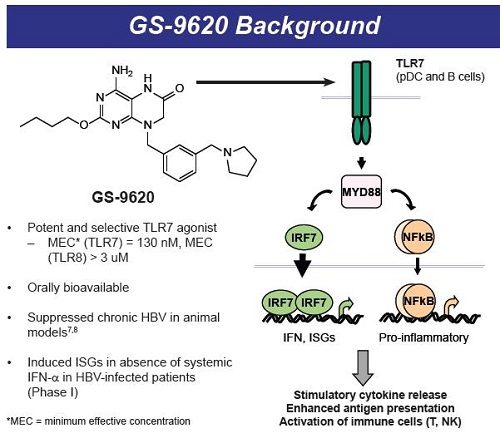
Il TLR7 viene espresso nelle cellule dendritiche plasmacitoidi e nei linfociti B ed è una componente del sistema immunitario innato, che si collega all’immunità adattiva.
L’attivazione del TLR7 comporta:
- - un aumento della presentazione dell’antigene;
- una maggiore attivazione delle cellule NK e dei CD8 (cioè della fase di “kill” del “kick and kill”);
- una attivazione dei CD4.
Il GS-9620 studiato in questa ricerca è un agonista selettivo del TLR7, assai potente e che può essere somministrato oralmente. Ha già dimostrato un’attività antivirale sia nelle marmotte, sia negli scimpanzé. Come già detto, viene sperimentato in un trial di fase II contro l’HBV e nel trial su scimmie di cui parliamo qui quello che è stato sperimentato è un suo analogo molto stretto.
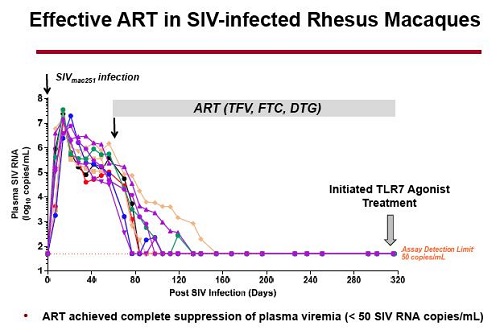
Lo studio sui macachi è stato impostato così:
- 10 macachi rhesus indiani (da 3 a 4 per gruppo) sono stati infettati per via rettale con SIVmac251. Il 65° giorno dopo l’infezione, gli animali sono stati messi in terapia con una co-formulazione di Gilead di tenofovir+ emtricitabina (cioè Truvada) + dolutegravir e hanno rapidamente raggiunto la soppressione della viremia.
320 giorni dopo l’infezione, è iniziata la somministrazione con dosi via via aumentate dell’agonista del TLR7 (una volta ogni due settimane, per 7 settimane). 6 scimmie hanno ricevuto un placebo.
L’end point principale era la valutazione dei cambiamenti nella cinetica dell’RNA virale nel plasma dopo la soppressione della ART.
Gli end point secondari erano gli effetti sulla viremia plasmatica e sulla attivazione immunitaria.
Il trattamento ha stimolato una transitoria e potente attivazione dei CD8 (e delle NK), e una attivazione via via sempre minore dei CD4
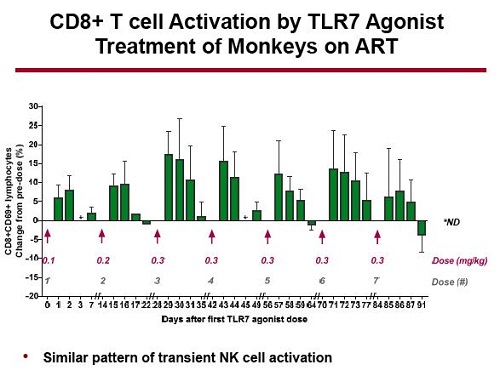
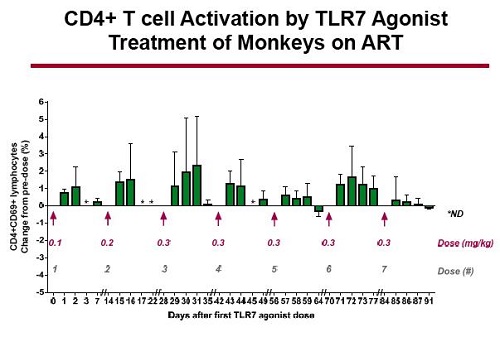
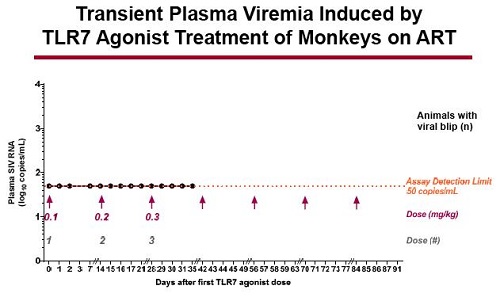
Il dato più importante emerso dallo studio è stata l’induzione di una transitoria e modesta viremia nel sangue delle scimmie mentre queste erano sotto ART. Questo si è verificato dopo che l’agonista del TLR7 era stato somministrato nel dosaggio maggiore. Nulla del genere si è visto negli animali che avevano ricevuto il placebo.
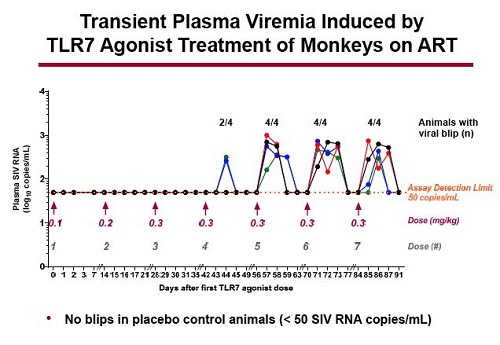
Quando hanno indagato la natura di questi blip, sequenziando la Gag nell’RNA virale trovato nel plasma e confrontandola con il DNA estratto da linfonodi e colon prima di iniziare la ART, hanno scoperto che era completamente identico. Quindi il virus riattivato veniva dal reservoir (peccato che né Sharon Lewin, né Rasmussen, abbiano fatto la stessa cosa con il virus dei pazienti che hanno avuto blip durante la somministrazione di vorinostat e panobinostat – sarebbe molto interessante fare dei confronti).
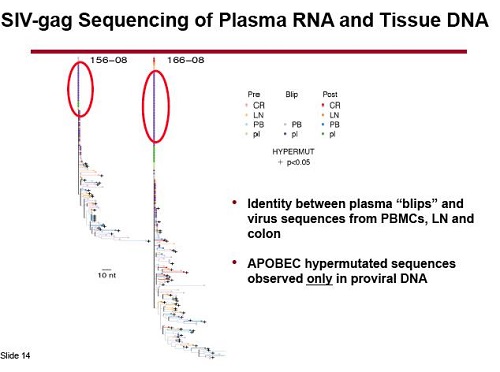
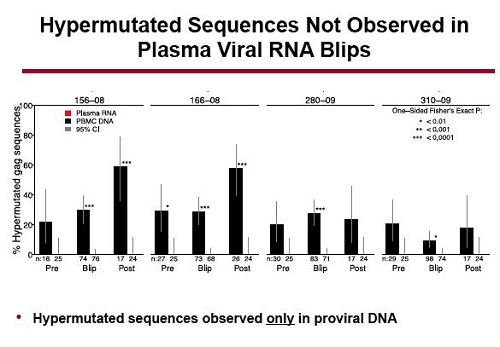
Invece, le sequenze ipermutate o altamente mutate presenti nel DNA provirale non sono state trovate nell’RNA emerso nel plasma durante i blip. Quel virus probabilmente difettivo pare non essere stato riattivato.
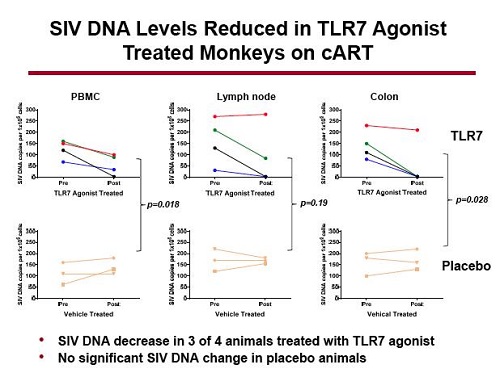
Che cosa è successo ai livelli di DNA virale dopo la somministrazione dell’agonista del TLR7?
Sono stati analizzati quelli nel sangue periferico, nei linfonodi e nel colon e, mentre i livelli di DNA nelle scimmie che avevano ricevuto il placebo sono rimasti costanti, quelli di 3 su 4 scimmie trattate sono diminuiti – in particolare, si è vista una diminuzione del DNA provirale molto consistente nei linfonodi e un vero e proprio crollo nel colon.
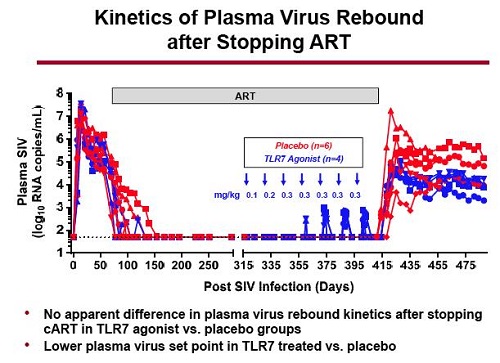
L’ultima slide riguarda la cinetica del rebound virale nel plasma dopo la sospensione della ART: mentre non si sono viste differenze significative fra il gruppo di scimmie trattate e quelle che hanno ricevuto il placebo nel rebound della viremia dopo l’interruzione degli antiretrovirali, si è invece osservata una chiarissima diminuzione del set point nelle scimmie che hanno ricevuto l’agonista del TLR7.
In conclusione, il trattamento con l’agonista del TLR7
- - ha indotto una viremia plasmatica, transitoria ma consistente, nelle scimmie che avevano viremia soppressa dalla ART;
- ha indotto una attivazione transitoria dei CD8 (e anche delle NK e dei CD4);
- ha portato a una diminuzione dei livelli di SIV DNA nei linfonodi, nel colon e nelle PBMC.
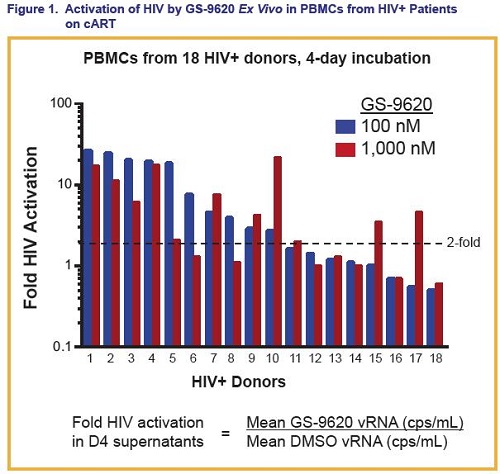
Passiamo ora a vedere il poster in cui sono descritti gli effetti ex vivo del GS-9620 sull’attivazione dell’HIV nelle PBMC di persone con viremia soppressa dalla ART da almeno 1 anno.
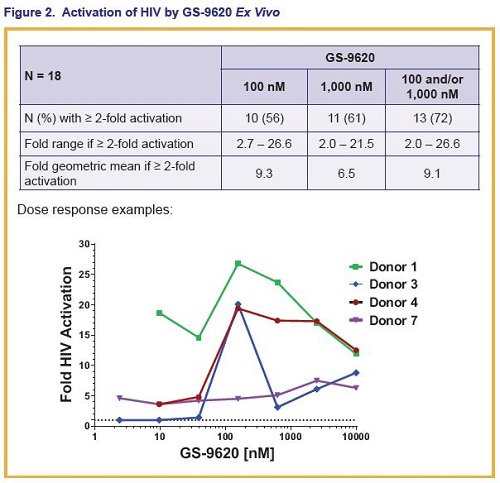
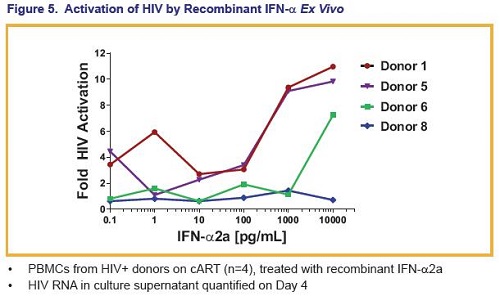
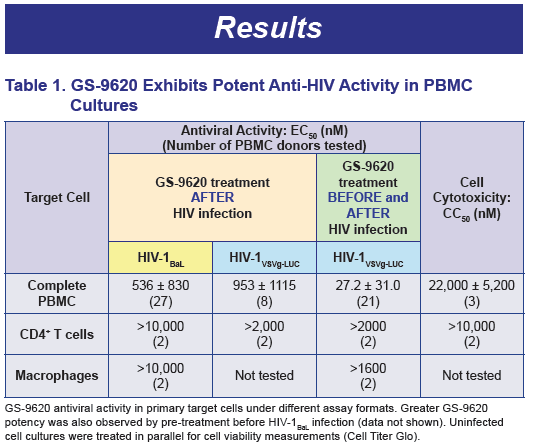
Anzitutto, il GS-9260 ha più che raddoppiato l’attivazione dell’HIV nelle PBMC di 13 su 18 (72%) dei donatori, con una media geometrica di un’attivazione di 9,1 volte.
La variazione in base al donatore dell’attivazione del virus può essere dovuta agli effetti combinati di “kick” e di “kill” del GS-9260.
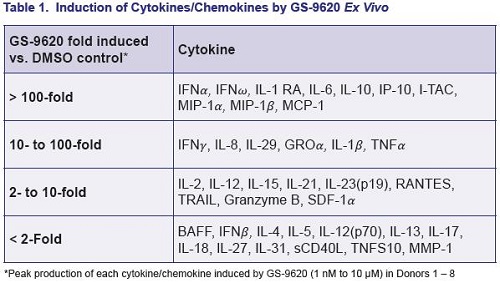
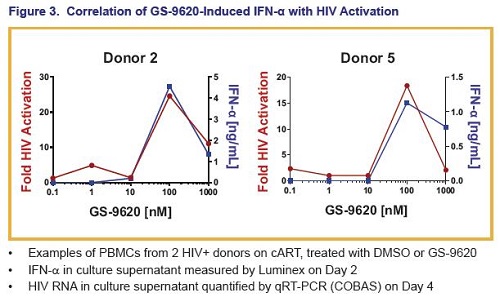
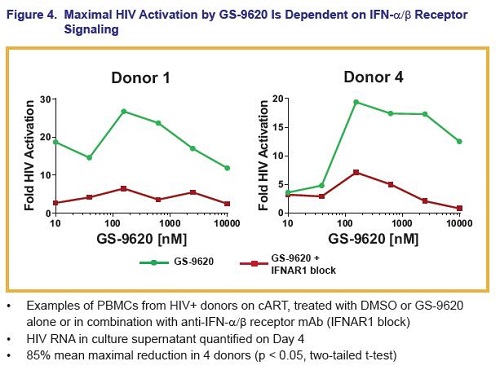
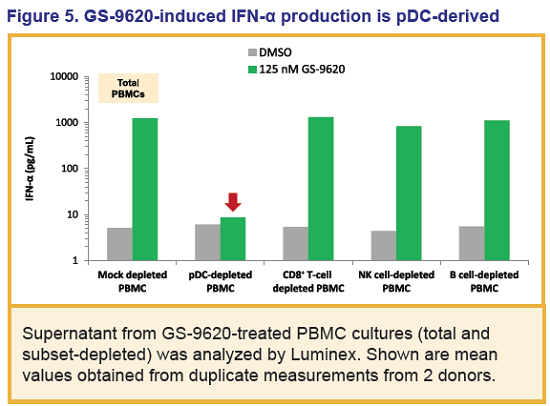
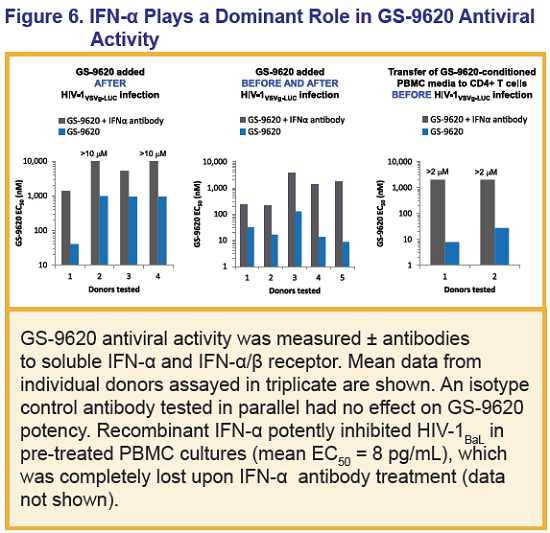
Inoltre, questo agonista del TLR7 ha indotto interferoni di tipo I e relative citochine.
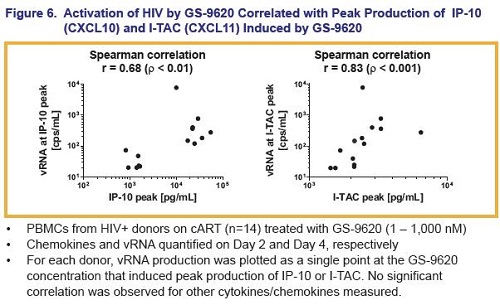
Si è poi osservata una correlazione fra i picchi dei livelli di certe particolari chemochine indotte dal GS-9260 e i livelli di attivazione dell’HIV – il ruolo di queste chemochine deve essere indagato.
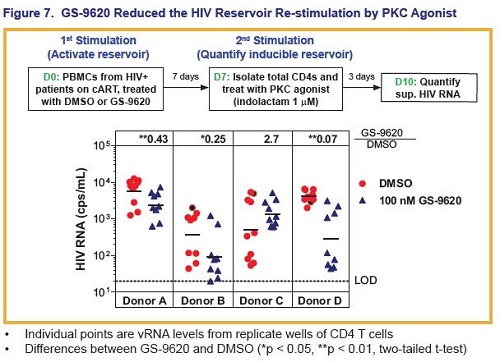
Il trattamento con GS-9260 ha ridotto la risposta del reservoir di HIV latente all’attivazione mediata da un agonista della PKC - bisognerà capire se questo indichi una riduzione del reservoir.
Considerando insieme questi risultati e quelli dello studio sulle scimmie, è iniziato uno studio clinico dell’uso di GS-9620 in persone con HIV e in terapia antiretrovirale (non è però segnalato in ClinicalTrials.gov anche se, a quanto pare, ha già completato l'arruolamento dei pazienti).
Le figure del poster con i dettagli dei risultati: