Altri HDACi anti-latenza in fase clinica: panobinostat
Re: Altri HDACi anti-latenza in fase clinica: panobinostat
non ho capito se la notizia è positiva oppure no.
Re: Altri HDACi anti-latenza in fase clinica: panobinostat
Avere un'espansione clonale delle cellule infette - come ci è stato detto in lungo e in largo durante questo CROI - non è proprio una gran bella cosa. Qui hanno dimostrato che la trascrizione del provirus latente stimolata dal panobinostat non è selettiva (tranne che nell'unico caso del paziente-pecora nera), cioè che effettivamente questo HDACi riesce a riattivare il virus nel reservoir, perché la grande diversità genetica sia dell'RNA, sia del DNA virali dice che quei virus non vengono da espansione clonale.Datex ha scritto:non ho capito se la notizia è positiva oppure no.
Direi che è una buona notizia.
Da temperare con i dati presentati nell'articolo, che ci dicono che l'attivazione è piuttosto modesta e che non si sono sostanzialmente misurate delle diminuzioni nelle dimensioni dei reservoir.
***************************
CROI 2015 – EFFETTI DI PANOBINOSTAT E ROMIDEPSINA SUI CD8
Completa il panobinostat al CROI 2015 un abstract sugli effetti della somministrazione in vivo di panobinostat e romidepsina sui CD8: #369 In vivo effects of Panobinostat and Romidepsin on HIV-1-specific CD8 T Cell Immunity.
Un lavoro molto utile, perché il dubbio che gli HDACi ai CD8 non facciano granché bene è stato avanzato da più parti.
Ne parlammo l'estate scorsa vedendo il lavoro di Bruce Walker e colleghi, in un post che per comodità ripropongo in parte qui:
La sfida lanciata da Walker e colleghi è stata raccolta dai ricercatori danesi che, ancora una volta insieme a Mathias Lichterfeld (Ragon Institute of MIT, MGH e Harvard), hanno studiato la funzionalità delle risposte dei CD8 HIV-specifici durante la somministrazione di panobinostat o di romidepsinaDora ha scritto:[...] è uscito su PLoS PATHOGENS un lavoro di cui Bruce Walker e colleghi del Massachussetts General Hospital, MIT e Harvard avevano dato anticipazione al workshop sui reservoir di Miami lo scorso dicembre, che ci racconta di un effetto inatteso non solo del vorinostat, ma anche e soprattutto di panobinostat e romidepsina - insomma, tutti e tre gli HDACi in sperimentazione clinica - che potrebbe avere delle conseguenze assai gravi su tutte le strategie di shock and kill, o kick and kill, o come le volete chiamare (flush and kill, le chiamano Walker e colleghi – forse proprio nel significato più familiare di “tirare lo sciacquone per eliminare … beh, lo sapete”), in cui le sostanze usate per la fase di shock sono questi inibitori dell'istone deacetilasi.
In Histone Deacetylase Inhibitors Impair the Elimination of HIV-Infected Cells by Cytotoxic T-Lymphocytes, infatti, Walker e colleghi fanno propria la lezione di Siliciano della necessità di rinforzare le reazioni citotossiche HIV-specifiche dei linfociti T CD8+ (CTL) per riconoscere ed eliminare le cellule in cui il virus è stato riattivato da qualche farmaco anti-latenza.
Si usano gli HDACi per imporre al virus latente di trascriversi, ma quali sono gli effetti degli HDACi sulle funzioni CTL dei CD8?
Capirlo è tanto più importante in quanto si sa che gli HDACi esercitano potenti e differenziati effetti sul sistema immune, sia quello innato, sia quello adattivo – in particolare, si sa che possono sopprimere la produzione di citochine infiammatorie; si sa che possono interferire nella differenziazione dei monociti in cellule dendritiche; e si sa che hanno un'attività immunosoppressiva che si è vista associata con benefici terapeutici in modelli murini di Graft versus Host Disease e di disordini auto-immuni.
Quello che Walker e colleghi hanno indagato in questo lavoro mediante una serie impressionante di esperimenti sono dunque stati gli effetti dei tre HDACi in sperimentazione clinica per arrivare a una cura dell’HIV – vorinostat, panobinostat e romidepsina – sulla funzionalità in vitro dei CD8 HIV-specifici.
I dettagli degli esperimenti possono essere visti nell’articolo. Io mi limito a sintetizzarne i risultati in due parole:
Questo effetto è stato osservato in vitro ed ex vivo e non è chiaro quale sia l’impatto degli HDACi in vivo sulle funzioni CTL delle persone con HIV. Ma Walker e colleghi ritengono che potrebbe essere ancor peggiore, soprattutto nel caso in cui queste risposte fossero prima state stimolate da una vaccinazione terapeutica, e potrebbe comportare un danno irreversibile delle risposte cellulari immuni HIV-specifiche - che è ragionevole pensare siano già state in parte danneggiate dall’azione del virus.
- mentre gli effetti individuali dei tre farmaci in esame sulle reazioni CTL HIV-specifiche presentavano delle differenze in funzione del tipo di modelli cellulari usati, del dosaggio dei farmaci e dei tempi di somministrazione, si è osservato che sia il vorinostat, sia ancor di più il panobinostat, sia soprattutto la romidepsina causano delle tossicità che danneggiano gravemente la capacità dei CD8 di uccidere le cellule infette in cui l’HIV è stato riattivato. In particolare, tutti e tre portano a una rapida soppressione della produzione da parte dei CD8 di interferone-γ (IFN-γ), che è un mediatore chiave della reazione immune.
Quella di stimolare le reazioni CTL con un vaccino terapeutico prima di trattare il reservoir latente con gli HDACi era la soluzione proposta da Siliciano e molti altri per riuscire a distruggere le cellule in cui il virus è stato riattivato e che non muoiono per gli effetti del virus stesso.
Da qui si vede che grande sfida venga posta ai trial futuri con HDACi dal lavoro di Walker e colleghi, i quali propongono anzitutto che negli studi già in corso e in quelli futuri sia incorporata come obiettivo primario la misurazione ex vivo della funzionalità dei linfociti T, e che l’immunosoppressione causata dagli HDACi sia considerata come un fattore che può potenzialmente limitare l’efficacia del trattamento con vorinostat, panobinostat e romidepsina.
Viene anche sottolineato chiaramente il rischio di trattare con gli HDACi persone con un sistema immunitario indebolito, che non si riprende completamente neppure grazie alla ART.
Poiché nei trial fatti in campo oncologico (nei quali però i dosaggi degli HDACi sono più alti) si è visto che un effetto collaterale abbastanza comune della romidepsina è la linfopenia e che si sono verificate talvolta infezioni anche serie, secondo Walker e colleghi è necessario incorporare come parametri di sicurezza nei futuri trial sull’eradicazione dell’HIV degli end point immunologici, per valutare costantemente l’impatto potenziale soprattutto della romidepsina sul sistema immunitario in generale.
Tutto questo, finché non si troverà qualche HDACi che funzioni meglio di quelli testati finora, inducendo l’espressione dell’HIV latente senza però danneggiare la capacità dei CD8 o di altre cellule del sistema immune come le NK di distruggere le cellule infette riattivate.
Si tratta di due trial clinici separati, in uno dei quali 20 mg di panobinostat, nell'altro 5 mg/m2 di romidepsina, sono stati somministrati a persone con viremia soppressa dalla ART.
Le cellule PBMC da analizzare (contenenti dunque cellule con marker di superficie diversi - CD4, CD8, CD45RA e CCR7) sono state prelevate prima, durante e dopo la somministrazione degli HDACi.
Non sono stati osservati cambiamenti statisticamente significativi sul numero totale dei CD8 fra prima e dopo i trattamenti. Tuttavia, durante il trattamento con panobinostat è cambiata la composizione relativa dei sottotipi di CD8: sono aumentati in modo significativo le proporzioni dei CD8 memoria effettori (p=0.005) e dei CD8 memoria centrali (p=0.03); invece sono diminuiti i CD8 naive (p=0.04).
Tutti i valori sono però tornati ai livelli di partenza quando i trattamenti sono terminati.
Durante il trattamento con romidepsina, invece, non si sono viste variazioni significative nella composizione dei sottogruppi dei CD8.
Secondo i ricercatori, questi risultati forniscono prove a sostegno dell'idea di combinare un HDACi con immunoterapie nei trial sull'eradicazione.
Re: Altri HDACi anti-latenza in fase clinica: panobinostat
finalmente qualche notizia positiva. anche se poco è già molto visti i problemi finora senza risposta. qualche dubbio è stato risolto.
Re: Altri HDACi anti-latenza in fase clinica: panobinostat
EFFETTI DEL PANOBINOSTAT SUL SISTEMA NERVOSO CENTRALEDora ha scritto:[...] I ricercatori danesi hanno portato al CROI [2014] anche un interessante lavoro in cui hanno cercato di dare una risposta alle preoccupazioni di coloro che temono che l’uso di HDACi per riattivare la trascrizione dell’HIV possa avere effetti dannosi a livello di sistema nervoso centrale. Si teme, infatti, che i CD4 riattivati o le proteine virali indotte dagli HDACi possano causare danno neuronale, o che si possa verificare a livello cerebrale una sindrome infiammatoria da ricostituzione immunitaria, o che le funzioni cerebrali possano essere intaccate dall’eliminazione di cellule della microglia e/o astrociti latentemente infetti.
#482 HIV reactivation by the histone deacetylase inhibitor panobinostat: Effects on CNS
Per valutare se la riattivazione del virus indotta dal panobinostat si associava ad effetti avversi nel sistema nervoso centrale, sono stati analizzati molti marker di neurodegenerazione e neuroinfiammazione prelevando da 11 dei 15 partecipanti al trial del liquido cerebrospinale, prima della prima dose di panobinostat e durante la settimana finale della sperimentazione.
Tutti i campioni di liquor prelevati erano negativi per l’HIV RNA, sia prima, sia durante il trattamento con panobinostat.
Non ci sono state variazioni nei marker presi in esame, né in quelli di neurodegenerazione, né in quelli di neuroinfiammazione.
Rasmussen e colleghi ne hanno concluso che ripetuti cicli di trattamento con panobinostat in pazienti HIV+ con viremia soppressa non hanno avuto associazione con eventi avversi a livello di sistema nervoso centrale.[...]
A un anno e mezzo di distanza dalla presentazione a un congresso dello studio sugli effetti del panobinostat sul sistema nervoso centrale, Rasmussen e colleghi hanno pubblicato su Open Forum Infectious Diseases il relativo articolo: Activation of Latent Human Immunodeficiency Virus by the Histone Deacetylase Inhibitor Panobinostat: A Pilot Study to Assess Effects on the Central Nervous System.
I risultati sono quelli già accennati, ma mi interessa riprendere il discorso sui farmaci anti-latenza e il reservoir cerebrale dopo la notizia riferita all'ultimo CROI di una scimmia che è stata trattata con ingenol-B e vorinostat e ha sviluppato un'encefalite, poiché quella notizia ha dato corpo a una delle paure espresse da Janice Clements nel famoso editoriale che scrisse per AIDS quattro anni fa e ricordate da Rasmussen e colleghi nell’articolo di oggi.
Almeno in alcune persone, infatti, cellule del sistema nervoso centrale quali i macrofagi, le microglia e gli astrociti possono rappresentare o un reservoir di HIV latente o un santuario di replicazione virale di basso livello. Non è però del tutto chiaro se queste popolazioni di cellule consentano la persistenza di un virus capace di replicarsi in persone in ART da diversi anni. Quindi è una questione ancora da chiarire quella dell’importanza, ai fini dell’eradicazione di HIV, di un reservoir virale nel sistema nervoso centrale ed è per questo che la Clements insieme a vari altri ricercatori hanno sottolineato la preoccupazione che le strategie di eradicazione studiate fino ad ora - come appunto quella di riattivare l’HIV dalla latenza somministrando degli HDACi - possano non riuscire ad eradicare il virus dal sistema nervoso centrale, ma avere invece conseguenze potenzialmente molto gravi sul cervello. Fra queste:
- 1. danno neuronale causato da proteine virali indotte dagli HDACi,
2. sindrome infiammatoria da ricostituzione immunitaria nel sistema nervoso centrale,
3. effetti negativi sulla funzionalità cerebrale causati dall’eliminazione di microglia e/o astrociti latentemente infetti,
4. danno neuronale causato dall’infiammazione indotta nel cervello dai linfociti T attivati.
Il danno al sistema nervoso può dunque essere inflitto sia direttamente dal virus, sia indirettamente dalle risposte infiammatorie associate al virus.
Poiché sia l’infezione nel sistema nervoso centrale, sia la neuroinfiammazione, sia la neurodegenerazione possono essere valutate misurando degli specifici marker nel liquido cerebrospinale, Rasmussen e colleghi hanno raccolto dati su questi marker mentre svolgevano il trial sul panobinostat, offrendoci così un primo studio sugli effetti degli HDACi a livello cerebrale che, se è piccolo e pieno di limitazioni, ha però il pregio di avere iniziato ad affrontare la questione.
Ricordo che lo studio ha coinvolto 15 persone con viremia soppressa dalla ART da almeno 2 anni e più di 500 CD4, che insieme ai loro regimi di ART hanno ricevuto oralmente 20 mg di panobinostat 3 volte a settimana, una settimana sì e una no, per un totale di 8 settimane (4 cicli di trattamento).
Per capire se la riattivazione del virus indotta dal panobinostat si associava a effetti avversi nel sistema nervoso centrale, 11 dei partecipanti hanno accettato di sottoporsi a puntura lombare subito prima dell’inizio del trattamento e durante l’ultimo ciclo.
A parte i livelli di panobinostat e quelli di HIV RNA nel liquido cerebrospinale, sono stati indagati una serie di marker di neurodegenerazione o di neuroinfiammazione elencati nelle due figure:
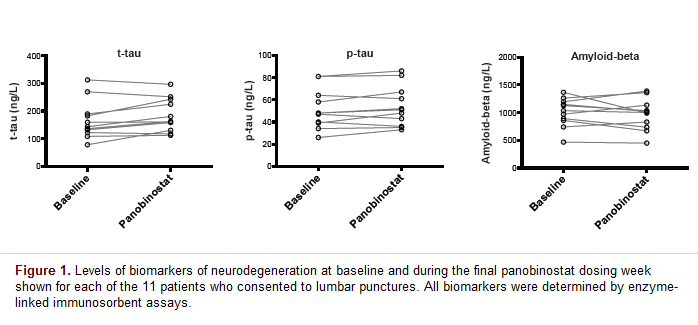
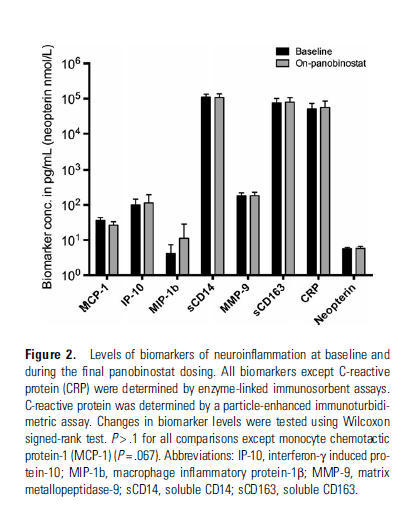
Come si vede dalle figure, non si sono osservati cambiamenti significativi nei marker fra l’inizio e la fine del trattamento. Né i livelli di questi marker sono stati visti in correlazione con i marker di infiammazione nel plasma o con le misure di attivazione dei linfociti T e dei monociti circolanti nel sangue.
Tutti i campioni, inoltre, sono risultati negativi per l’HIV RNA, sia prima del trattamento, sia durante. Invece, in 6 di quegli 11 pazienti l’HIV RNA nel plasma è risultato rilevabile al momento della rachicentesi.
In tutti i campioni raccolti, infine, il panobinostat era sotto la soglia di rilevabilità dei test.
I danesi riconoscono che questo loro studio presenta diverse limitazioni, sia perché era un sottostudio esplorativo, per quanto stabilito già nel protocollo iniziale, quindi potrebbe non essere abbastanza potente per individuare cambiamenti molto piccoli nei marker studiati, sia perché mancava un gruppo di controllo, sia perché non sono stati fatti test neuropsicologici ai partecipanti che avrebbero potuto dare indicazioni ulteriori su eventuali effetti del trattamento, sia perché i campioni di liquor prelevati erano limitati e non hanno permesso di fare analisi più sensibili sulle viremie e sui cambiamenti epigenetici nel comparto cerebrale. Infine, dare una interpretazione clinica chiara di tutti questi marker non è facile, perché ciascuno può avere più di un significato, non necessariamente patologico.
Va dunque da sé che le osservazioni fatte in questo studio dovranno essere approfondite e non sono sufficienti a fugare le preoccupazioni che gli HDACi possano avere effetti negativi sul sistema nervoso centrale.
Ma in primo luogo ci devono arrivare nel sistema nervoso centrale. E in questo studio Rasmussen e colleghi ci dicono che il panobinostat nel cervello o non ci è arrivato o, se l’ha fatto, era in quantità così infinitesime da non poter essere rilevate.
Esistono studi preclinici in cui si è visto che il vorinostat e la romidepsina riescono almeno in una certa misura a superare la barriera emato-encefalica. Ma sul panobinostat non si sa nulla. Ora sappiamo che o non riesce a penetrare nel sistema nervoso centrale, oppure ci riesce ma a dei livelli bassissimi.
Comprensibile, allora, che di danni non ne abbia fatti. Però in questo caso anche il reservoir eventualmente presente è stato lasciato intatto.
D’altra parte, l’induzione della trascrizione di HIV e la produzione di proteine virali in altri comparti dell’organismo possono portare a una penetrazione di prodotti virali nel cervello e quindi stimolarvi dei processi infiammatori. Quindi degli effetti avversi potrebbero comunque verificarsi anche senza che il panobinostat superi la barriera emato-encefalica.
Ci sarà da studiare ancora.