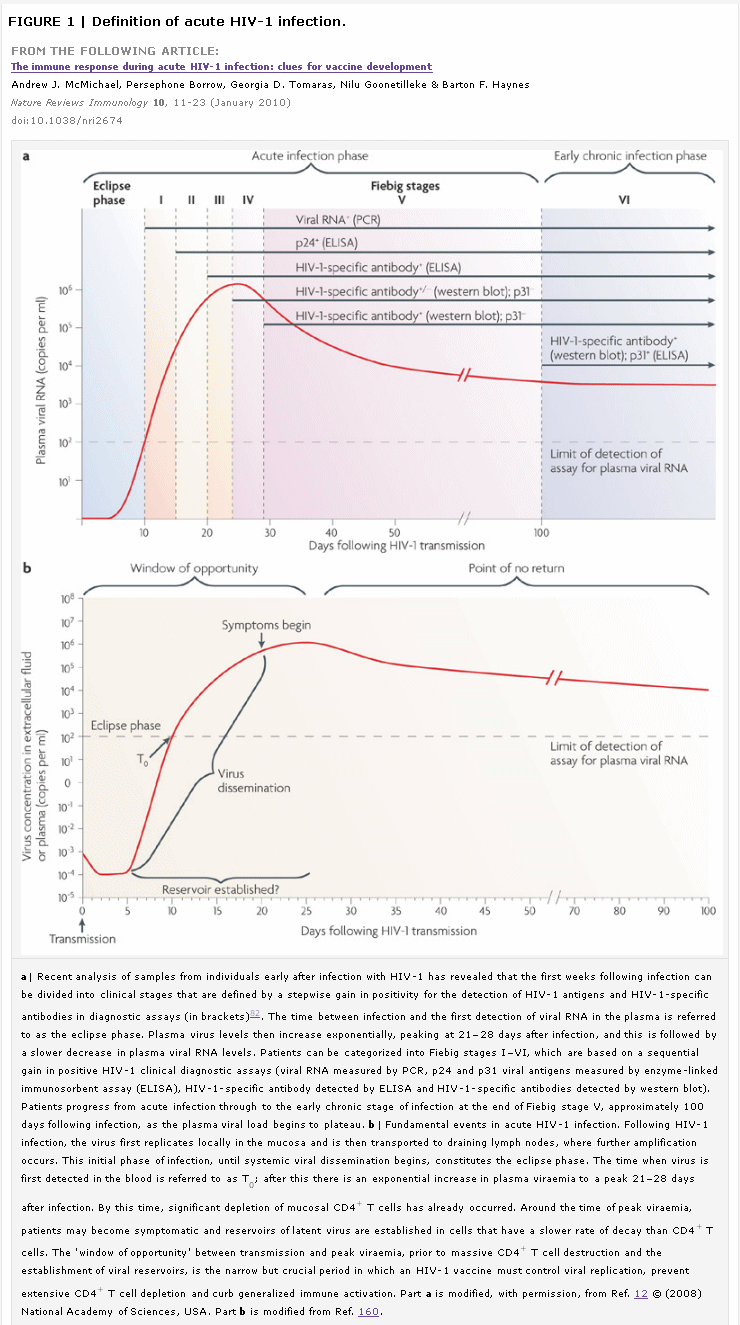
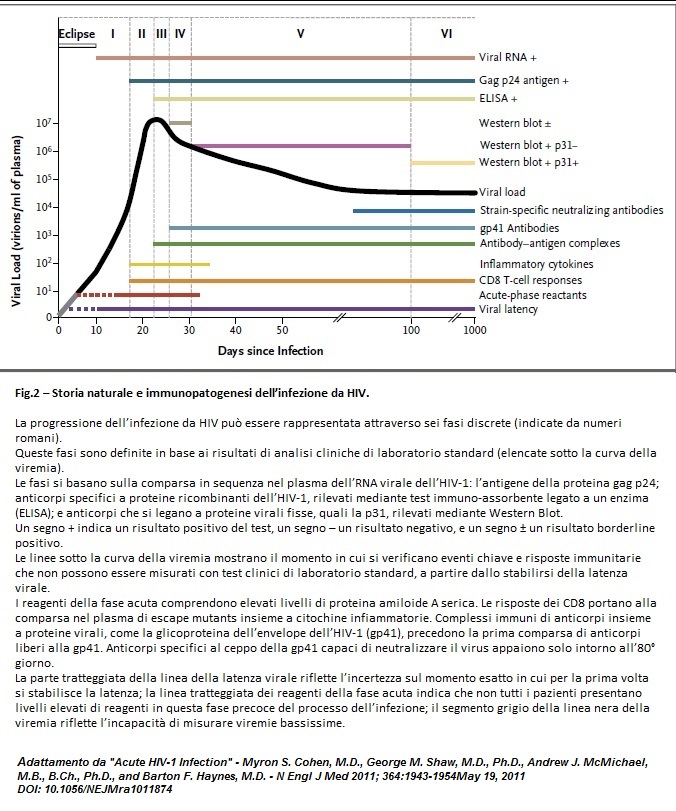
Leon ha scritto:BISOGNA INNANZITUTTO ACCERTARE SE IL FENOMENO ESISTE O NO (dove nel "no" comprendo anche artefatti statistici più o meno involontari.
Ho letto l’articolo di Sara Lodi e colleghi sui 259 pazienti (su poco più di 25.600) tratti dal CASCADE ed entrati in terapia entro 3 mesi dal momento della sieroconversione. È molto interessante, perché dà una sua risposta alla domanda se il fenomeno dei “post-treatment controllers (PTC)” esista o no.Richard Jefferys ha scritto:Una analisi indipendente della frequenza dei PTC – che gli autori riconoscono essere nata sulla scia dei dati della VISCONTI – è stata pubblicata online il 23 luglio negli Archives of Internal Medicine. Sono state identificate 259 persone tratte dalla coorte multi-nazionale CASCADE per aver ricevuto la ART entro 3 mesi dal momento dell’infezione. In questa analisi, la probabilità di mantenere lo status di PTC a 24 mesi dall’interruzione della ART è stata del 5,5%, e le caratteristiche di queste 11 persone non differivano da quelle del resto della popolazione studiata.
La sua risposta è SÌ:
- “la maggior parte dei pazienti sperimenta un rebound del virus molto rapidamente dopo l’interruzione della ART; ciò nondimeno, anche se i PTC sono rari, i risultati di questo studio confermano la loro esistenza.”
Racconto brevemente come Lodi e colleghi sono arrivati a questa conclusione.
La frequenza dei PTC secondo la lettera di Hocqueloux a AIDS del 2010 è 15,6%. Incredibilmente più alta rispetto allo 0,5% di pazienti che ci si attende riescano a controllare da soli, senza farmaci, la viremia.

Questo ha spinto i ricercatori del CASCADE (Concerted Actionon Seroconversion to AIDS and Death in Europe), un insieme di diverse coorti di pazienti in Europa, Australia, Canada e Africa sub-sahariana, di cui si conosce la data di sieroconversione, a raccogliere i dati relativi ai 259 pazienti che rispondevano a questi criteri:
- 1. meno di tre mesi fra l’ultimo test negativo e il primo positivo e/o prove di laboratorio di sieroconversione acuta (positività alla real time PCR in assenza di anticorpi o antigeni con meno di 4 bande del WB);
2. inizio della ART entro 3 mesi dalla sieroconversione e somministrazione della terapia per almeno 3 mesi;
3. successo della terapia (HIV RNA < 50 copie/mL durante la ART);
4. interruzione di ogni trattamento antiretrovirale per 30 giorni o meno.
In queste persone, è stato stimato il tempo mediano intercorso dall’interruzione della ART alla perdita dello status di PTC, definita come la data di ripresa della terapia e la prima di due volte consecutive in cui i livelli di HIV RNA sono stati maggiori di 50 copie/mL.
La probabilità di mantenere lo status di PTC a 12 e a 24 mesi dall’interruzione della ART è stata stimata, rispettivamente, dell’8,2% (95% CI, 5.2%-12.2%) e del 5.5% (95% CI, 3.1%-9.0%).
- • 11 persone hanno mantenuto lo status di PTC per 24 mesi dopo l’interruzione della terapia e avendo preso la ART per un tempo mediano di 1 anno (range: 0,7-1).
• La loro età mediana era di 29 (28-37) anni; 4 erano donne.
• 5 erano state trattate con una combinazione iniziale contenente un IP boosterizzato; 2 con un IP non boosterizzato; 4 con un NNRTI.
• Il numero mediano di CD4 nel periodo di sospensione della terapia era 901 (764-1048).
• Le caratteristiche di questi pazienti e la loro storia terapeutica non differivano in modo significativo da quelle della popolazione complessiva dei 259 pazienti.
Lodi e colleghi sostengono che i risultati della loro ricerca confermano l’esistenza dei PTC, anche se si tratta di casi rari e molto meno rispetto ai dati di Hocqueloux: 5,5% di pazienti, a 2 anni dalla sospensione della terapia.
Ritengono che questi risultati discordanti possano dipendere dall’impostazione dello studio: Hocqueloux ha incluso solo le persone che non avevano assunto ARV per almeno 24 mesi; Lodi ha incluso tutti coloro che erano a rischio di perdere lo status di PTC dopo interruzione della ART. In questo modo, le persone che hanno mantenuto lo status di PTC per meno di 24 mesi sono state escluse dalla valutazione del rischio. È quindi possibile che sia stata inclusa nello studio una selezione di pazienti che non hanno avuto bisogno di terapia per almeno 24 mesi, e che pertanto avevano un miglior profilo virologico.
L’analisi di Lodi e colleghi, permettendo l’inclusione di tutte le persone a rischio di perdere lo status di PTC, fornisce pertanto una stima più accurata.